-
Molaridad y molalidad de dos disoluciones de ácido a partir de la dilución de uno de ellos
Determina el volumen de ácido nítrico, con densidad 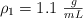 y al
y al 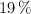 en peso, que puede prepararse diluyendo con agua 50 mL de otro ácido, con densidad
en peso, que puede prepararse diluyendo con agua 50 mL de otro ácido, con densidad 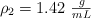 y al
y al 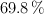 en peso. Calcula además la molaridad y molalidad de cada una de las disoluciones.
en peso. Calcula además la molaridad y molalidad de cada una de las disoluciones.
-
Molalidad de una disolución de glucosa (5529)
Al mezclar 30 g de glucosa (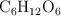 ) con 150 g de agua se obtienen 178 mL de disolución. Calcula la molalidad de la disolución.
) con 150 g de agua se obtienen 178 mL de disolución. Calcula la molalidad de la disolución.
Masas atómicas: C = 12 ; H = 1 ; O = 16.
-
Molalidad de una disolución de NaCl, sabiendo su densidad (5374)
Calcula la molalidad de una disolución acuosa de 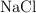 0.15 M cuya densidad es
0.15 M cuya densidad es 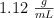 .
.
-
Fracción molar, molaridad y molalidad de una disolución de butanol (5280)
Una disolución contiene masas iguales de butanol y agua, con una densidad de 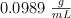 . Calcula la molaridad, molalidad y fracción molar del butanol y el agua.
. Calcula la molaridad, molalidad y fracción molar del butanol y el agua.
Masas molares del butanol y del agua: 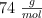 y
y 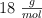 .
.
-
Punto de ebullición del disolvente conociendo la temperatura de ebullición de una disolución de urea
La urea es un compuesto que se utiliza como fuente de nitrógeno para las plantas. Se estima que un 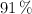 de lo producido a nivel mundial se direcciona a ser fertilizante. Si disolvemos 12 g de urea
de lo producido a nivel mundial se direcciona a ser fertilizante. Si disolvemos 12 g de urea 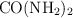 en 100 g de disolvente, la temperatura a la que ebulle es
en 100 g de disolvente, la temperatura a la que ebulle es 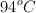 . Determina el punto de ebullición del disolvente puro si la constante ebulloscópica es
. Determina el punto de ebullición del disolvente puro si la constante ebulloscópica es 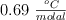 .
.
Masas atómicas: C = 12 ; N = 14 ; H = 1 ; O = 16.
 Molalidad
Molalidad