-
Fracción molar del etino y Principio de Le Chatelier en la reacción del metano(7122)
Para la reacción:
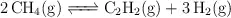
a 2 000 K, la constante de equilibrio 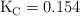 . Si en un volumen de 1.00 L de una mezcla en equilibrio a 2 000 K hay 0.10 moles de
. Si en un volumen de 1.00 L de una mezcla en equilibrio a 2 000 K hay 0.10 moles de 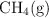 y 0.10 moles de
y 0.10 moles de 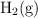 :
:
a) ¿Cuál es la fracción molar de 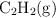 ?
?
b) ¿Cuándo está favorecida la conversión de 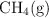 a
a 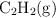 , a altas o a bajas presiones?
, a altas o a bajas presiones?
c) Si la mezcla en equilibrio a 2 000 K se traslada del matraz de 1.00 L a otro de 2.00 L, ¿aumentará, disminuirá o permanecerá constante el número de moles de 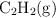 ?
?
-
Equilibrio de descomposición del carbamato de amonio (6848)
El carbamato de amonio 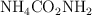 es una sustancia de uso común (como fertilizante) con un equilibrio sólido-vapor que ha sido ampliamente estudiado desde mediados del siglo XIX y que actualmente está considerado como la base de la tecnología más avanzada (SCR, reducción catalítica selectiva) para la reducción de emisiones de óxidos de nitrógeno en motores diesel exigida por las nuevas legislaciones internacionales:
es una sustancia de uso común (como fertilizante) con un equilibrio sólido-vapor que ha sido ampliamente estudiado desde mediados del siglo XIX y que actualmente está considerado como la base de la tecnología más avanzada (SCR, reducción catalítica selectiva) para la reducción de emisiones de óxidos de nitrógeno en motores diesel exigida por las nuevas legislaciones internacionales:
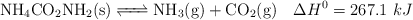
Para determinar su grado de disociación hasta alcanzarse dicho equilibrio se introducen 75.0 gramos de carbamato de amonio en un recipiente hermético de 750 mL. El equilibrio se alcanza a una temperatura constante de 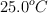 , registrándose una presión de 0.116 atm y un valor de
, registrándose una presión de 0.116 atm y un valor de 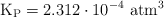 .
.
a) Determina el grado de disociación del carbamato de amonio.
b) Determina las concentraciones de todas las especies en el equilibrio.
c) Determina el valor de 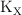 .
.
d) ¿Hacia dónde se desplazará la reacción hasta alcanzar un nuevo equilibrio si se incrementa la temperatura?
-
Aplicación del principio de Le Chatelier a la descomposición del N2O3
El trióxido de dinitrógeno se descompone en 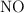 y
y 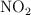 en el siguiente proceso endotérmico (
en el siguiente proceso endotérmico (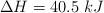 ):
):
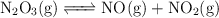
Predice cómo afectará el equilibrio cuando se produzcan los siguientes cambios:
a) Agregar más 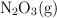 .
.
b) Agregar más 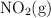 .
.
c) Aumentar el volumen.
d) Reducir la temperatura.
-
Análisis de la evolución del equilibrio de la descomposición del HI (6456)
En un recipiente de un litro de capacidad se introducen 0.4 moles de yoduro de hidrógeno, 0.2 moles de yodo y 0.1 moles de hidrógeno. La  para la descomposición del yoduro de hidrógeno ajustada a dos moles descompuestos, vale
para la descomposición del yoduro de hidrógeno ajustada a dos moles descompuestos, vale 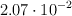 a una temperatura de 1 000 K.
a una temperatura de 1 000 K.
a) Discute que reacción se verá favorecida para que la reacción alcance el equilibrio.
b) Calcula el porcentaje que hay de cada gas en el equilibrio.
c) Si para el mismo equilibrio, inicialmente solo se hubiesen introducido 64 g de yoduro de hidrógeno, ¿qué tanto por ciento quedaría sin disociar una vez alcanzado el equilibrio? ¿Cuánto valdría el grado de disociación?
d) Discute y justifica la evolución del equilibrio si: i) se disminuye la temperatura (la descomposición es exotérmica); ii) se añade yodo; iii) se añade al recipiente un gas noble (que no reacciona) y iv) se añade un catalizador.
-
Principio de Le Chatelier aplicado al equilibrio de ionización del HCN (6283)
El cianuro de hidrógeno es un líquido muy venenoso y altamente volátil, soluble en agua, en donde origina ácido cianhídrico. Considera la ionización del ácido cianhídrico en disolución acuosa e indica cómo resulta afectado el porcentaje de ionización de dicho ácido en los siguientes casos, justificando tus respuestas:
a) Agregado de una pequeña cantidad de hidróxido de sodio.
b) Agregado de cianuro de sodio.
c) Agregado de cloruro de sodio.
d) Aumento del volumen del recipiente.
e) Aumento de la temperatura.
 Le Chatelier
Le Chatelier