-
Masa de ácido acético en una muestra de vinagre y porcentaje en masa (6518)
El vinagre es una solución de ácido acético en agua. Cuando se titulan 50.0 mL de una muestra de vinagre con una solución 0.1055 M de NaOH, se necesitan 41.09 mL para alcanzar el punto final. La reacción que tiene lugar es:

a) Calcula la masa de ácido acético en la muestra.
b) Calcula el porcentaje en masa del ácido acético en el vinagre si su densidad es 1.052 g/mL.
-
Concentración de un ácido usado para neutralizar una disolución de NaOH
Se tienen 5 g de hidróxido de sodio, a los cuales se les agrega agua hasta alcanzar un volumen de 250 mL y se utilizan 25 mL de esta disolución para titular una alícuota de 50 mL de ácido clorhídrico. Calcula la molaridad del ácido.
-
Valoración de una dilución de una botella de ácido sabiendo el volumen de base
Se toman 5 mL de una botella de 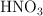 con el fin de conocer su concentración molar. Esta alícuota se diluye en un matraz aforado de 500 mL y se toman 10 mL, consumiendo 25 mL de NaOH (0.1M) para llegar al punto de equivalencia con fenolftaleina. ¿Cuál es la concentración molar de la botella de
con el fin de conocer su concentración molar. Esta alícuota se diluye en un matraz aforado de 500 mL y se toman 10 mL, consumiendo 25 mL de NaOH (0.1M) para llegar al punto de equivalencia con fenolftaleina. ¿Cuál es la concentración molar de la botella de 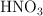 ?
?
-
Masa de ácido nicotínico y porcentaje en una muestra aislada
Una investigadora aísla una muestra de ácido nicotínico, 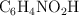 , un miembro importante del grupo vitamínico B. Para determinar su pureza, hace una valoración de 0.450 g de muestra con una disolución
, un miembro importante del grupo vitamínico B. Para determinar su pureza, hace una valoración de 0.450 g de muestra con una disolución 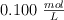 de
de 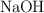 . Se necesitan 36.2 mL de la disolución de
. Se necesitan 36.2 mL de la disolución de 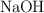 para alcanzar el punto final de la valoración. Calcula:
para alcanzar el punto final de la valoración. Calcula:
a) La masa, en gramos, de ácido nicotínico que contiene la muestra.
b) El porcentaje de ácido nicotínico en la muestra.
-
Normalidad de una solución de ácido sulfúrico valorada con KOH (6434)
Para neutralizar 800 mL de ácido sulfúrico se necesitaron 100mL de solución de hidróxido de potasio cuya densidad es 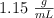 y
y 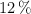 en masa. Calcula la normalidad de la solucion ácida.
en masa. Calcula la normalidad de la solucion ácida.
 Neutralización
Neutralización