-
Equilibrio de descomposición del carbamato de amonio (6848)
El carbamato de amonio 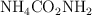 es una sustancia de uso común (como fertilizante) con un equilibrio sólido-vapor que ha sido ampliamente estudiado desde mediados del siglo XIX y que actualmente está considerado como la base de la tecnología más avanzada (SCR, reducción catalítica selectiva) para la reducción de emisiones de óxidos de nitrógeno en motores diesel exigida por las nuevas legislaciones internacionales:
es una sustancia de uso común (como fertilizante) con un equilibrio sólido-vapor que ha sido ampliamente estudiado desde mediados del siglo XIX y que actualmente está considerado como la base de la tecnología más avanzada (SCR, reducción catalítica selectiva) para la reducción de emisiones de óxidos de nitrógeno en motores diesel exigida por las nuevas legislaciones internacionales:
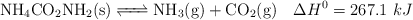
Para determinar su grado de disociación hasta alcanzarse dicho equilibrio se introducen 75.0 gramos de carbamato de amonio en un recipiente hermético de 750 mL. El equilibrio se alcanza a una temperatura constante de 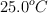 , registrándose una presión de 0.116 atm y un valor de
, registrándose una presión de 0.116 atm y un valor de 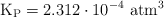 .
.
a) Determina el grado de disociación del carbamato de amonio.
b) Determina las concentraciones de todas las especies en el equilibrio.
c) Determina el valor de 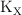 .
.
d) ¿Hacia dónde se desplazará la reacción hasta alcanzar un nuevo equilibrio si se incrementa la temperatura?
-
Refuerzo: constante de equilibrio conociendo los moles iniciales (6814)
Reaccionan inicialmente 8 moles de 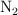 , 22 moles de
, 22 moles de 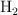 y 2 moles de
y 2 moles de 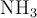 . Determina la constante de equilibrio
. Determina la constante de equilibrio  sabiendo que en el equilibrio han quedado 2 moles de
sabiendo que en el equilibrio han quedado 2 moles de 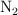 y el volumen total es 1 L.
y el volumen total es 1 L.
-
KC y KP para una reacción sabiendo los moles iniciales y el grado de disociación (6727)
Se ha estudiado la reacción del equilibrio siguiente, a 735 K y en un volumen de un litro:
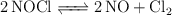
Inicialmente se introdujeron 2 moles de 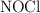 . Una vez alcanzado el equilibrio se comprobó que se había disociado en un
. Una vez alcanzado el equilibrio se comprobó que se había disociado en un 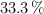 del compuesto. Calcula los valores de
del compuesto. Calcula los valores de  y
y  .
.
-
KP y KC de un equilibrio de disociación conocido el grado de disociación (6725)
A 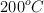 y presión de 1atm, el
y presión de 1atm, el 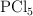 se disocia en
se disocia en 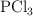 y
y 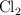 en un
en un 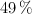 .Calcula:
.Calcula:
a)  y
y  .
.
b) El grado de disociación a la misma temperatura pero a 10 atm de presión.
-
Presión parcial del CO a la que es letal
La hemoglobina (Hb) puede formar un complejo con  o con
o con 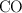 . Para la siguiente reacción, a temperatura corporal,
. Para la siguiente reacción, a temperatura corporal, 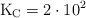 aproximadamente.
aproximadamente.

Cuando la relación ![\frac{[\ce{HbCO}]}{[\ce{HbO2}]} \frac{[\ce{HbCO}]}{[\ce{HbO2}]}](local/cache-TeX/3aab6fd7b82ea4d76fc01dd0b477bcb8.png) tiende a uno, la muerte es probable. ¿A qué presión parcial el
tiende a uno, la muerte es probable. ¿A qué presión parcial el 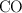 en el aire probablemente sea mortal? Asume que la presión parcial del
en el aire probablemente sea mortal? Asume que la presión parcial del  es 0.20 atm.
es 0.20 atm.
 Constante equilibrio
Constante equilibrio