-
Presiones parciales y presión total en la descomposición del fosgeno
Para el equilibrio:
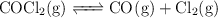
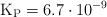 a determinada temperatura. Si al inicio la presión inicial del
a determinada temperatura. Si al inicio la presión inicial del 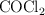 puro es 0.87 atm:
puro es 0.87 atm:
a) ¿Cuáles serán las presiones parciales en el equilibrio de 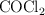 ,
, 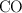 y
y 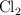 ?
?
b) ¿Cuál será la presión total en el equilibrio?
-
Concentración y masa inicial de un reactivo sabiendo la constante de equilbrio
En un recipiente de 5.00 L se introduce cloruro de amonio y se calientan a 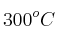 hasta que se alcanza el equilibrio, obteniendo como productos amoniaco y el ácido clorhídrico. Sabemos que en el equilibrio el amoniaco presenta una concentración de 0.92 mol/L y el ácido clorhídrico 1.40 mol/L. Si sabemos que
hasta que se alcanza el equilibrio, obteniendo como productos amoniaco y el ácido clorhídrico. Sabemos que en el equilibrio el amoniaco presenta una concentración de 0.92 mol/L y el ácido clorhídrico 1.40 mol/L. Si sabemos que 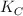 vale 0.0256:
vale 0.0256:
a) Plantea la ecuación química de la reacción en estudio.
b) Determina la concentración inicial y la cantidad química de cloruro de amonio de la cual se parte para que se dé la reacción.
-
Concentraciones en el equilibrio de la reacción entre nitrógeno y oxígeno
Para la ecuación química:
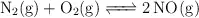
La constante de equilibrio 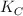 vale 0.00243 a 800 K. Si mezclamos 1.40 mol de
vale 0.00243 a 800 K. Si mezclamos 1.40 mol de 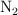 y 0.650 mol de
y 0.650 mol de  en un recipiente de 2.50 L a esa misma temperatura. Calcula la concentración para cada una de las especies en el equilibrio.
en un recipiente de 2.50 L a esa misma temperatura. Calcula la concentración para cada una de las especies en el equilibrio.
-
Concentraciones en equilibrio, Kc y Kp en la reacción de formación del amoniaco (6221)
En un recipiente de 10 L se introducen 1 mol de nitrógeno y 2 mol de hidrógeno, ambos en estado gaseoso, que se calientan hasta 618 K. Una vez que se alcanza el equilibrio, se obtiene una mezcla que ejerce una presión total de 9.48 atm según la reacción:
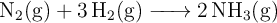
Calcula:
a) Las concentraciones de 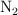 ,
, 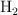 y
y 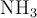 en el equilibrio.
en el equilibrio.
b) La  .
.
c) La  .
.
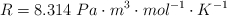
-
Valor de Kc y Kp la disociación del POCl3
En un recipiente de 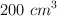 se colocan 0.4 g de
se colocan 0.4 g de 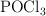 . Se calienta a
. Se calienta a 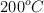 y el
y el 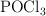 se vaporiza y se disocia en un
se vaporiza y se disocia en un 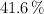 en
en 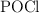 y
y 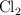 según el equilibrio:
según el equilibrio:
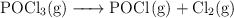
Calcula las constantes 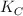 y
y 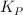 .
.
 Constante equilibrio
Constante equilibrio