-
Masa atómica y masas isotópicas (2355)
Un elemento presenta dos isótopos cuyos números de masa son 33 y 35. Si el peso atómico es 33.8; halla la abundancia relativa del isótopo pesado.
-
Relación entre masas isotópicas y masa atómica (2354)
Un elemento tiene dos isótopos de tal forma que el primero tiene tiene dos neutrones más que el segundo. Si la abundancia relativa del primero con respecto al segundo está en una relación de 3 a 2; halla el número másico del más abundante, si su masa atómica promedio es 61.2.
-
Abundancias relativas de dos isótopos a partir de la masa atómica (2283)
Un elemento tiene peso atómico 34.5 u. Este elemento está compuesto por dos isótopos de masas 30 y 36. Calcula las abundancias relativas de cada isotopo.
-
Masa atómica del azufre a partir de sus masas isotópicas y abundancias relativas (2170)
Existen, en forma natural, cuatro isótopos del azufre que son: 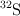 con
con 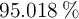 ;
; 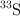 con
con 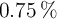 ;
; 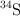 con
con 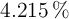 y
y 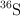 con
con 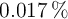 de abundancia en la naturaleza. ¿Cuál debe ser la masa atómica promedio de azufre?
de abundancia en la naturaleza. ¿Cuál debe ser la masa atómica promedio de azufre?
-
Masa de un isótopo del indio (2141)
El elemento indio tiene como peso atómico 114.818 u. Si el número de masa de uno de sus isótopos es 115, ¿cuál es la masa isotópica del segundo isótopo que tiene una abundancia relativa de 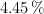 ?
?
 Isótopos
Isótopos