-
Estequiometría de reactivos y productos en la combustión de benceno (6125)
La combustión del benceno (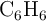 ) da como resultado la formación de dióxido de carbono y agua. Si se obtuvieron 25.8 L de dióxido de carbono, medidos en condiciones normales, calcula:
) da como resultado la formación de dióxido de carbono y agua. Si se obtuvieron 25.8 L de dióxido de carbono, medidos en condiciones normales, calcula:
a) Los gramos de agua que se formaron.
b) El volumen de benceno que reaccionó.
c) El volumen del aire, medido a 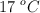 y 0.86 atm, que se necesitó.
y 0.86 atm, que se necesitó.
Considera que la densidad del benceno es igual a 0.88 g/mL y que el contenido de oxígeno en el aire es del 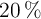 en volumen.
en volumen.
-
Volumen de ácido clorhídrico para neutralizar un volumen de hidróxido de calcio (6124)
Determina el volumen de ácido clorhídrico 0.25 M necesario para que reaccionen completamente 125 mL de disolución de hidróxido de calcio 0.2 M sabiendo que los productos de la reacción son cloruro de calcio y agua.
-
Entalpía de combustión del octano a partir de las entalpías de formación (6121)
El motor de una máquina cortacésped funciona con una gasolina de composición única de octano (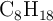 ). Calcula:
). Calcula:
a) La entalpía de combustión estándar del octano aplicando la ley de Hess.
b) El calor que se desprende en la combustión de 2 kg de octano.
Masas atómicas: C = 12 u ; O = 16 u ; H = 1 u. Las entalpías estándar de formación del 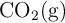 , del
, del 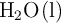 y del
y del 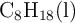 son respectivamente:
son respectivamente: 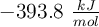 ;
; 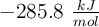 y
y 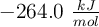 .
.
-
Reciclaje de latas para obtener estaño y producir óxido de estaño(IV) (6106)
A partir del reciclado de latas de conserva se puede obtener «Sn» y una empresa utiliza esta materia prima para la obtención de 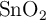 , que es un material base para la elaboración de sensores de gas. La reacción del proceso es la siguiente:
, que es un material base para la elaboración de sensores de gas. La reacción del proceso es la siguiente:
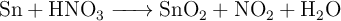
Teniendo en cuenta que cada lata pesa 16 g, de los cuales el 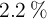 en peso es Sn, responde:
en peso es Sn, responde:
a) Si el rendimiento de la reacción es del 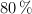 , ¿cuántas latas de conserva son necesarias para producir 70 g de
, ¿cuántas latas de conserva son necesarias para producir 70 g de 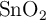 ?
?
b) ¿Cuál es la masa mínima de 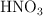 necesaria para que reaccione toda la cantidad de Sn requerida en este proceso?
necesaria para que reaccione toda la cantidad de Sn requerida en este proceso?
c) El 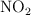 es un subproducto de la reacción, ¿qué volumen debería tener dicho recipiente para que, a
es un subproducto de la reacción, ¿qué volumen debería tener dicho recipiente para que, a 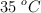 , soporte una presión de 1.5 atm?
, soporte una presión de 1.5 atm?
Masas atómicas: Sn = 118.7; N = 14; O = 16; H = 1.
-
Balanceo de ecuaciones redox (6100)
Balancea las siguientes ecuaciones de oxidación-reducción:
a) 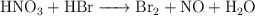
b) 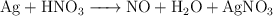
c) 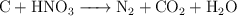
d) 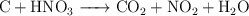
e) 
f) 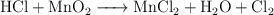
g) 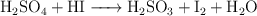
 Ajuste
Ajuste