-
Ley de la proporción constante (5950)
Con 50 g de oxígeno, ¿qué masa de 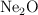 puedo obtener? Las masas atómicas de Ne y O son 20 y 16 respectivamente.
puedo obtener? Las masas atómicas de Ne y O son 20 y 16 respectivamente.
-
Ley de Proust y ley de conservación de la masa (5901)
Atacando con flúor 3.855 g de aluminio se forman 11.997 g de fluoruro de aluminio. Calcula la cantidad de flúor necesaria para atacar completamente 25.000 g de aluminio.
-
Masa atómica del potasio a partir de la relación de masas entre los reactivos (5874)
Una muestra de 27.37 g de potasio metálico se trata con exceso de oxígeno, convirtiéndose por completo en óxido de potasio. La masa final es 32.97 g. Conocida la masa atómica del oxígeno, 16.0 u. Calcula la masa atómica del potasio.
-
Masas iniciales de H y O en una reacción en la que se forma agua y sobra oxígeno (5634)
El hidrógeno y el oxígeno se combinan para formar agua en una relación constante de masa de 1.0 g de hidrógeno por 8.0 g de oxígeno. En una experiencia se han formado 90 g de agua y ha quedado un exceso de oxígeno sin reaccionar de 10 g. Calcula las masas iniciales de hidrógeno y oxígeno.
-
Ley de Proust aplicada a la formación del agua
Un estudiante sabe que en la formación del agua 4 g de 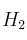 reaccionan completamente con 32 g de
reaccionan completamente con 32 g de 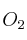 . Si, bajo las mismas condiciones de reacción, se hacen reaccionar 4 g de
. Si, bajo las mismas condiciones de reacción, se hacen reaccionar 4 g de 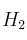 con 16 g de
con 16 g de 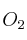 , ocurrirá que:
, ocurrirá que:
a) Se formarán 10 g de 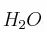 y sobrarán 2 g de
y sobrarán 2 g de 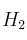 .
.
b) Se formarán 20 g de 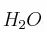 y no sobrará nada de
y no sobrará nada de 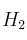 y
y 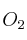 .
.
c) Se fromarán 14 g de 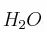 y sobrarán 4 g de
y sobrarán 4 g de 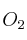 .
.
d) Se formarán 18 g de 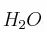 y sobrarán 2 g de
y sobrarán 2 g de 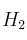 .
.
 Ley de Proust
Ley de Proust