-
Composición centesimal de una mezcla de antraceno y naftaleno a partir del descenso crioscópico (6162)
Se disuelven 5 g de una mezcla de naftaleno (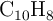 ) y antraceno (
) y antraceno (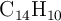 ), en 300 g de benceno (
), en 300 g de benceno (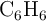 ) y la disolución congela a
) y la disolución congela a 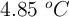 . Calcula la composición porcentual en masa de la muestra de naftaleno y antraceno, sabiendo que la
. Calcula la composición porcentual en masa de la muestra de naftaleno y antraceno, sabiendo que la 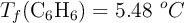 y la constante
y la constante 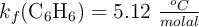
-
Ampliación: presión osmótica en disoluciones de electrolitos y no electrolitos (6044)
Se prepararon dos tubos en U con disoluciones 1 M separadas por una membrana semipermeable. En el tubo A se puso una disolución de NaCl y otra de KCl y en el tubo B se colocó una disolución de glucosa y otra de cloruro de sodio.
En el tubo A no ocurrió nada y en ambos brazos del tubo las soluciones permanecen en el mismo nivel. En el tubo B se observa un aumento del volumen en el brazo del tubo correspondiente a la disolución de NaCl.
1. Analiza las semejanzas y diferencias existentes entre los solutos utilizados en cada uno de los tubos y propón una hipótesis de lo observado.
2. Si las disoluciones tienen la misma concentración, ¿por qué crees que en el tubo B el gradiente de transporte a través de la membrana va de la disolución de glucosa a la de NaCl?
-
Masa molecular de un compuesto a partir del aumento ebulloscópico en su disolución (6012)
Se prepara una disolución disolviendo 1.50 g de un compuesto en 25.0 mL de agua a  . El punto de ebullición de esta disolución es de
. El punto de ebullición de esta disolución es de 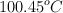 .
.
a) ¿Cuál será la masa molar del compuesto si es un no electrolito no volátil y la disolución se comporta de forma ideal?
b) Mediciones de conductividad de la disolución estudiada indican que el compuesto en realidad es iónico con fórmula general 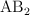 o
o 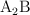 (siendo A un catión y B un anión). ¿Cuál sería entonces la masa molar del compuesto si la disolución se comporta idealmente?
(siendo A un catión y B un anión). ¿Cuál sería entonces la masa molar del compuesto si la disolución se comporta idealmente?
c) El análisis de la composición indica una fórmula empírica de 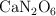 . Explica la diferencia entre la masa de la fórmula real y la calculada a partir del experimento de aumento ebulloscópico.
. Explica la diferencia entre la masa de la fórmula real y la calculada a partir del experimento de aumento ebulloscópico.
Datos: 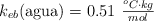 ;
; 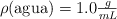
-
Volumen de una disolución comparado con el del disolvente puro
Si se tienen 6 mL de agua y se le agregan 3 g de cloruro de sodio, razona si el volumen de la disolución es mayor o menor que el del disolvente puro.
-
Masa de nitrato de cinc necesaria para una disolución isotónica (5613)
Un gramo de sacarosa (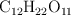 ) está disuelto en
) está disuelto en 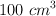 de agua a la temperatura de
de agua a la temperatura de 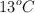 . Halla los gramos de nitrato de cinc disueltos en
. Halla los gramos de nitrato de cinc disueltos en 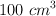 de agua que forman una disolución isotónica a la anterior, teniendo en cuenta que a
de agua que forman una disolución isotónica a la anterior, teniendo en cuenta que a 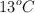 el nitrato de cinc está ionizado al
el nitrato de cinc está ionizado al 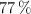 .
.
Masas atómicas: H = 1 ; C = 12 ; N = 14 ; O = 16 ; Zn = 65.
 Propiedades coligativas
Propiedades coligativas