-
Masa de disolución de dimetilglioxima para precipitar el níquel de un acero
Una muestra de 0,9984 g de acero contiene un 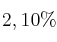 de níquel. El níquel se determina mediante precipitación utilizando dimetilglioxima. ¿Qué volumen de una disolución, que es
de níquel. El níquel se determina mediante precipitación utilizando dimetilglioxima. ¿Qué volumen de una disolución, que es 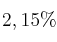 en peso de dimetilglioxima, se necesita para que se tenga un
en peso de dimetilglioxima, se necesita para que se tenga un 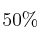 de exceso de agente precipitante al llevar a cabo la reacción de precipitación?
de exceso de agente precipitante al llevar a cabo la reacción de precipitación?
La reacción que tiene lugar es:
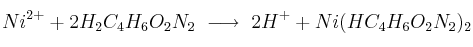
Masas atómicas: Ni = 58,7 ; C = 12 ; H = 1 ; O = 16 ; N = 14.
-
Volumen de disolución diluida y molaridad a partir de una disolución concentrada
a) ¿Qué volumen de ácido para baterías de 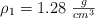 y
y 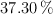 en masa, de
en masa, de 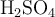 puro, se puede preparar a partir de
puro, se puede preparar a partir de 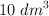 de una solución concentrada acuosa de ácido sulfúrico de
de una solución concentrada acuosa de ácido sulfúrico de 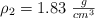 y al
y al 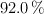 en masa?
en masa?
b) ¿Cuál es la concentración molar de la solución obtenida?
Masas atómicas: S = 32 ; O = 16 ; H = 1.
-
Molaridad y molalidad de dos disoluciones de ácido a partir de la dilución de uno de ellos
Determina el volumen de ácido nítrico, con densidad 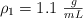 y al
y al 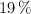 en peso, que puede prepararse diluyendo con agua 50 mL de otro ácido, con densidad
en peso, que puede prepararse diluyendo con agua 50 mL de otro ácido, con densidad 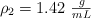 y al
y al 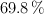 en peso. Calcula además la molaridad y molalidad de cada una de las disoluciones.
en peso. Calcula además la molaridad y molalidad de cada una de las disoluciones.
-
Masa de soluto necesaria y masa total de disolución para aumentar el porcentaje en masa (5625)
Se quiere preparar una disolución de cloruro de bario al 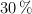 en peso utilizando 400 g de una disolución acuosa al
en peso utilizando 400 g de una disolución acuosa al 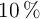 de dicha sustancia y la misma en estado sólido. Determina:
de dicha sustancia y la misma en estado sólido. Determina:
a) La masa de soluto necesaria.
b) La masa de la disolución final.
-
Masa de KCl necesaria para elevar el porcentaje en peso de una disolución
Determina la masa de cloruro de potasio que deberá agregarse a 500 g de solución acuosa de esa sal al 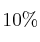 en peso para elevar su concentración al
en peso para elevar su concentración al 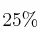 en peso.
en peso.
 Porcentaje en masa
Porcentaje en masa