-
Rendimiento de la reacción entre yodato de potasio e hidracina
El yodato de potasio sólido (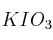 ), reacciona con la hidracina líquida (
), reacciona con la hidracina líquida (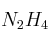 ), para dar:
), para dar:
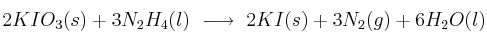
Si se someten a reacción 500 g de yoduro de potasio con 200 g de hidracina, determina:
a) La masa sobrante del reactivo en exceso.
b) La masa de yoduro de potasio (KI), que se forma con 100 g de 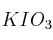 y un exceso de
y un exceso de 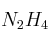 .
.
c) El rendimiento de la reacción, si al reaccionar 15.1 g de 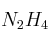 y un exceso de
y un exceso de 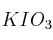 , se obtienen experimentalmente 35.50 g de KI.
, se obtienen experimentalmente 35.50 g de KI.
Masas atómicas: I = 127 u ; N = 14 u ; H = 1 u ; O = 16 u ; K = 39 u.
-
Reacción entre el dióxido de manganeso y el cloruro de hidrógeno (4744)
Al tratar una muestra de dióxido de manganeso con 20 g de cloruro de hidrógeno, se obtiene cloruro de manganeso(II), gas cloro y agua. Escribe y ajusta la reacción y calcula la masa de cloruro de manganeso(II) que se obtendrá.
Datos: Cl = 35.5 ; H = 1 ; Mn = 55.
-
Volumen de amoniaco al reaccionar 10 kg de nitrógeno (6149)
Una forma de sintetizar el gas amoniaco (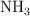 ) es combinando los gases nitrógeno y oxígeno a temperaturas y presiones extremadamente altas. Escribe la ecuación balanceada y calcula qué volumen de amoniaco se obtiene cuando 10 kg de nitrógeno se combinan con hidrógeno en exceso a
) es combinando los gases nitrógeno y oxígeno a temperaturas y presiones extremadamente altas. Escribe la ecuación balanceada y calcula qué volumen de amoniaco se obtiene cuando 10 kg de nitrógeno se combinan con hidrógeno en exceso a 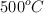 y 250 atm.
y 250 atm.
-
Reactivo limitante: cantidad de PCl3 que se obtiene (4885)
¿Qué masa de 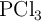 se forma en la reacción de 125 g de
se forma en la reacción de 125 g de 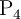 con 323 g de
con 323 g de 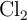 ?
?
La reacción que tiene lugar es:
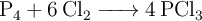
-
Estequiometría de reactivos y productos en la combustión de benceno
La combustión del benceno (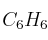 ) da como resultado la formación de dióxido de carbono y agua. Si se obtuvieron 25.8 L de dióxido de carbono, medidos en condiciones normales, calcula:
) da como resultado la formación de dióxido de carbono y agua. Si se obtuvieron 25.8 L de dióxido de carbono, medidos en condiciones normales, calcula:
a) Los gramos de agua que se formaron.
b) El volumen de benceno que reaccionó.
c) El volumen del aire, medido a 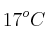 y 0.86 atm, que se necesitó.
y 0.86 atm, que se necesitó.
Considera que la densidad del benceno es igual a 0.88 g/mL y que el contenido de oxígeno en el aire es del  en volumen.
en volumen.
 Reacciones químicas
Reacciones químicas