-
pH de una disolución de un ácido triprótico y porcentaje de disociación en cada etapa (8433)
Se prepara una disolución acuosa de ácido cítrico (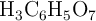 ) con una concentración inicial de 0.05 M. El ácido cítrico es un ácido triprótico con las siguientes constantes de acidez a
) con una concentración inicial de 0.05 M. El ácido cítrico es un ácido triprótico con las siguientes constantes de acidez a 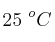 :
:
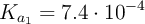 ;
; 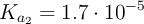 ;
; 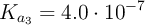
a) Calcula el pH de la disolución resultante, teniendo en cuenta las tres etapas de disociación.
b) Determina las concentraciones de todas las especies presentes en la disolución en equilibrio.
c) Calcula el porcentaje de cada etapa de disociación.
d) Calcula el pH de la disolución resultante después de añadirle 0.025 moles de NaOH.
-
Moles de HCl para variar el pH de un búfer amonio/amoniaco (7475)
¿Cuántos moles de HCl se deben agregar a 1 L de una disolución amortiguadora, de concentraciones 0.84 M en amoniaco y 0.96 M en cloruro de amonio, para obtener una disolución de pH = 8.56? Supón que el volumen permanece constante.
Dato: 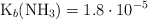
-
Fuerza iónica de un búfer de sales de fosfato (7242)
Calcula la fuerza iónica de una solución acuosa que contiene 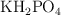 , con concentración
, con concentración 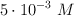 y
y 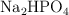 , con concentración
, con concentración 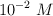 .
.
Datos: 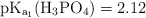 ;
; 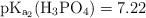 ;
; 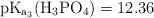
-
pH de un búfer de amoniaco y amonio (6608)
Se preparó una solución reguladora agregando a 1.0 L de solución de amoniaco, de concentración 3.4 g/L, cloruro de amonio en cantidad suficiente para que su concentración fuera 0.15 M. Calcula el pH de dicho amortiguador.
Dato: 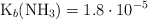 .
.
-
Volúmenes de ácido y sal del ácido para hacer una disolución reguladora de un pH dado
Se dispone de dos disoluciones: una 0.1 M de ácido acético y otra 0.1 M de acetato de sodio. ¿Qué volúmenes de cada una de ellas se deben mezclar para obtener 100 mL de una disolución reguladora de pH = 5.30?
Supón que los volúmenes son aditivos y toma como dato 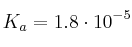 para el ácido acético.
para el ácido acético.
 Disolución tampón
Disolución tampón