Un mol de un gas ocupa un volumen de 10 L cuando está sometido a una presión de 745 mm Hg y a una temperatura de -138 ºC. ¿Se trata de un gas ideal?
Un recipiente contiene 20 mol de helio que ocupan un volumen de 15 L medidos a 1,5 atm. Si se extraen 5 mol de gas, la presión desciende a 750 torr. ¿Cuál será el nuevo volumen de helio en estas condiciones?
Un depósito que contiene gas propano tiene un volumen de ![]() a una presión de 4 atm. Determina cuántos cilindros de 200 L de capacidad, a presión de 2 atm y a la misma temperatura, se podrían llenar con la masa de gas contenida en el depósito.
a una presión de 4 atm. Determina cuántos cilindros de 200 L de capacidad, a presión de 2 atm y a la misma temperatura, se podrían llenar con la masa de gas contenida en el depósito.
¿Cuál será la masa de oxígeno necesaria para la combustión completa de 1.22 g de magnesio, sabiendo que al final de la reacción se obtienen 2.02 g de óxido de magnesio? ¿En qué ley fundamental se basa la respuesta?
Al reaccionar azufre y oxígeno para formar tres óxidos distintos se han obtenido los siguientes resultados:
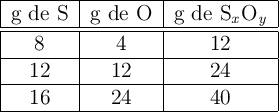
Comprueba que se cumple la ley de las proporciones múltiples.
Sabiendo que la proporción entre el calcio y el oxígeno es de 8:3, ¿qué cantidad de oxígeno se necesita para formar 200 g de óxido de calcio?
Un proceso de chapado electrolítico de estaño da un recubrimiento con un espesor de ![]() . ¿Cuál será el área de la superficie que puede cubrirse por este método, si se utilizan 0.50 kg de estaño? La densidad del estaño es de
. ¿Cuál será el área de la superficie que puede cubrirse por este método, si se utilizan 0.50 kg de estaño? La densidad del estaño es de ![]() .
.
El cloroformo es un compuesto penta-atómico que a ![]() es un líquido de densidad
es un líquido de densidad ![]() . Sabiendo que 0,250 mol de cloroformo ocupan 20,0 mL a esa temperatura, indica el número de átomos totales contenidos en 50,0 g de cloroformo.
. Sabiendo que 0,250 mol de cloroformo ocupan 20,0 mL a esa temperatura, indica el número de átomos totales contenidos en 50,0 g de cloroformo.
Dato: ![]() .
.
Una muestra de glucosa, ![]() , contiene
, contiene ![]() átomos de carbono.
átomos de carbono.
a) ¿Cuántos átomos de hidrógeno contiene?
b) ¿Cuántas moléculas de glucosa contiene?
c) ¿Cuántos moles de glucosa contiene?
d) Calcula la masa de la muestra en gramos.
 Ejercicios FyQ
Ejercicios FyQ