a) Calcula la presión manométrica, expresada en bar, que corresponde a una presión absoluta de 2.30 bar.
b) Determina la presión absoluta, en bar, equivalente a una lectura de 500 mbar de vacío.
Considera que la presión atmosférica es 930 mbar en ambos casos.
Tres frascos de 1 L, todos a ![]() , han sido intercomunicados mediante espitas inicialmente cerradas. El primer frasco contiene 1 g de
, han sido intercomunicados mediante espitas inicialmente cerradas. El primer frasco contiene 1 g de ![]() , el segundo contiene
, el segundo contiene ![]() a la presión de 1 atm y el tercero 1 g de
a la presión de 1 atm y el tercero 1 g de ![]() . A la temperatura de
. A la temperatura de ![]() , la presión de vapor del agua es 0.038 atm. Calcula:
, la presión de vapor del agua es 0.038 atm. Calcula:
a) La presión inicial en cada frasco.
b) Si se abren las espitas y se espera a que se alcance el equilibrio, ¿cuál será la presión en el sistema?
c) Si la temperatura del sistema se eleva a ![]() , ¿cuál será entonces la presión?
, ¿cuál será entonces la presión?
Una llanta tiene forma de toroide, cuyo volumen se puede calcular a partir de los parámetros R y r de la figura y aplicando la fórmula ![]() :
:
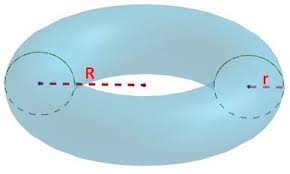
(siendo R = 42.5 cm y r = 17.5 cm).
Cierto día se llenó la llanta con aire a temperatura ambiente (![]() ) y una presión manométrica de 20 psi. Al finalizar el viaje la temperatura de la llanta se elevó a
) y una presión manométrica de 20 psi. Al finalizar el viaje la temperatura de la llanta se elevó a ![]() . Considerando que la presión atmosférica es 12.8 psi calcula:
. Considerando que la presión atmosférica es 12.8 psi calcula:
a) La presión manométrica que registrará la llanta al finalizar el viaje, considerando que el volumen se mantiene constante. Recuerda que para usar las leyes de los gases se debe usar la presión absoluta en todos los cálculos.
b) La masa de aire que se perdió durante el recorrido si la presión manométrica que registra en las condiciones finales fuese de 15 psi.
Considera que la masa molar del aire es 29 g/mol.
Se desea comprimir 10 lb de ![]() a un volumen de 20
a un volumen de 20 ![]() . Calcula la presión, en psi (
. Calcula la presión, en psi (![]() ), a la que es necesario llevar al gas siendo la temperatura de
), a la que es necesario llevar al gas siendo la temperatura de ![]() .
.
Dato: ![]() ; C = 12 ; O = 16.
; C = 12 ; O = 16.
Siendo la presión total de un recipiente 680 torr, ¿cuál es la presión parcial de cada gas, sabiendo que están contenidos 4 litros de cloro, 7 litros de nitrógeno y 6 litros de oxígeno?
La masa molar aparente de una mezcla gaseosa compuesta por ![]() y
y ![]() es 22.4 g/mol. Si 10 moles de la mezcla ocupan un volumen de 4.2 L a
es 22.4 g/mol. Si 10 moles de la mezcla ocupan un volumen de 4.2 L a ![]() . Determina la presión parcial de cada gas.
. Determina la presión parcial de cada gas.
En un recipiente rígido de ![]() se colocan 25 g de etano,
se colocan 25 g de etano, ![]() moléculas de metano y otro gas, siendo la temperatura
moléculas de metano y otro gas, siendo la temperatura ![]() y la presión 3 atm. Calcula las presiones parciales del etano y del otro gas en la mezcla.
y la presión 3 atm. Calcula las presiones parciales del etano y del otro gas en la mezcla.
Una mezcla de 50 g de oxígeno y 50 g de metano se coloca en un recipiente a la presión de 600 mm Hg. ¿Cuál será la presión parcial del oxígeno molecular?
Un recipiente rígido de 2 L de capacidad contiene 0.18 g de nitrógeno gaseoso a ![]() . Si se agrega argón gaseoso a la misma temperatura hasta que la presión inicial del recipiente se triplica, ¿cuál será la presión parcial de Ar en la solución gaseosa resultante?
. Si se agrega argón gaseoso a la misma temperatura hasta que la presión inicial del recipiente se triplica, ¿cuál será la presión parcial de Ar en la solución gaseosa resultante?
Un sistema cerrado con un volumen de 1 L, contiene gas radón y agua líquida, y se deja que el recipiente llegue al equilibrio a ![]() hasta que la presion total sea constante. ¿Cuál es la presión parcial del radón si la presión total es 15 psi?
hasta que la presion total sea constante. ¿Cuál es la presión parcial del radón si la presión total es 15 psi?
Datos: ![]() ;
; ![]()
 Ejercicios FyQ
Ejercicios FyQ