La concentración de ![]() en la atmósfera está aumentando de forma constante debido al uso de combustibles fósiles cómo fuente de energía y es teóricamente posible demostrar que este hecho es el causante de producir un incremento de la temperatura de la Tierra (efecto invernadero).
en la atmósfera está aumentando de forma constante debido al uso de combustibles fósiles cómo fuente de energía y es teóricamente posible demostrar que este hecho es el causante de producir un incremento de la temperatura de la Tierra (efecto invernadero).
Escribe las reacciones balanceadas de combustión de los siguientes combustibles:
a) Hidrógeno (![]() )
)
b) Propano (![]() )
)
c) Metano (![]() )
)
Indica razonadamente cuál de ellos desprende mayor cantidad de calor por gramo quemado y cuál es el que menos contamina.
Cuando se mezclan 100 mL de una disolución de hidróxido de calcio (1 M) con 80 mL de una disolución de ácido clorhídrico (1,5 M) se produce una reacción de neutralización. Determina la cantidad de cloruro de calcio que se obtendrá y el calor intercambiado en la reacción.
Datos: ![]() ;
; ![]() ;
; ![]() ;
; ![]() ; H = 1 ; Cl = 35,5 ; O = 16 ; Ca = 40.
; H = 1 ; Cl = 35,5 ; O = 16 ; Ca = 40.
Dada la siguiente ecuación termoquímica:
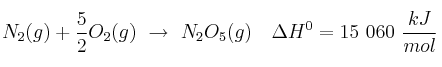
Calcula el calor (en kJ) que es absorbido durante la formación de 25,0 g de ![]() .
.
Determina el calor que se liberará al quemarse 2 litros de metano medidos a ![]() y 1 atm de presión, sabiendo que la
y 1 atm de presión, sabiendo que la ![]() .
.
Si se hace la combustión de 200 litros de metanol, siendo la densidad del etanol ![]() y su masa molecular
y su masa molecular ![]() , ¿cuál será el calor producido expresado en kcal?
, ¿cuál será el calor producido expresado en kcal?
Dato: ![]()
Conociendo la entalpía de formación estándar del dióxido de carbono, ![]() , determina:
, determina:
a) La energía correspondiente a la formación de 4 g de dióxido de carbono.
b) La entalpía de combustión estándar del carbono.
Un recipiente que contiene 2 kg de agua se coloca en una estufa caliente y el contenido se agita violentamente por medio de un mezclador que realiza un trabajo mecánico de 6 kJ sobre el agua. La temperatura del agua de eleva en ![]() . ¿Qué cantidad de calor fluyó hacia el agua desde la estufa durante el proceso?
. ¿Qué cantidad de calor fluyó hacia el agua desde la estufa durante el proceso?
Calor específico del agua: 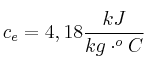
Tres moles de un gas ideal experimentan una expansión isotérmica contra una presión de oposición constante de 100 kPa desde ![]() hasta
hasta ![]() . Calcula Q, W,
. Calcula Q, W, ![]() y
y ![]() .
.
Una muestra de 155 g de ![]() se expande isotérmicamente desde un volumen de 19 L hasta otro de 25 L a
se expande isotérmicamente desde un volumen de 19 L hasta otro de 25 L a ![]() . Determina el trabajo, el calor y la variación de la energía interna asociados al proceso, expresando la respuesta en julio.
. Determina el trabajo, el calor y la variación de la energía interna asociados al proceso, expresando la respuesta en julio.
Dato: ![]()
Un proceso industrial necesita 36 200 kJ que se obtienen quemando, en condiciones estándar, 422 L de una mezcla de etano y propano. Calcula:
a) El calor de combustión del etano y del propano.
b) La composición molar, en porcentaje, del gas utilizado.
Datos en kJ/mol:
![]() ;
; ![]() ;
; ![]() ;
; ![]()
 Ejercicios FyQ
Ejercicios FyQ