Si tenemos 37 g de agua a ![]() y suministramos
y suministramos ![]() de energía, ¿en qué fase y a qué temperatura se encontrará el agua?
de energía, ¿en qué fase y a qué temperatura se encontrará el agua?
La longitud de una arista de un cubo de aluminio es de 5.00 cm, medida a ![]() . Si se calienta hasta
. Si se calienta hasta ![]() , calcula:
, calcula:
a) La longitud de la arista a esa temperatura.
b) El incremento de volumen del cubo metálico.
Dato: ![]()
Teniendo en cuenta los siguientes datos, obtenidos en la combustión de una muestra de la xilosa ![]() en un calorímetro de bomba, calcula el calor de combustión de la xilosa, expresado en kJ/mol:
en un calorímetro de bomba, calcula el calor de combustión de la xilosa, expresado en kJ/mol:
La masa de ![]() son 1.250 g, la capacidad calorífica del calorímetro es
son 1.250 g, la capacidad calorífica del calorímetro es ![]() , la temperatura inicial del calorímetro es
, la temperatura inicial del calorímetro es ![]() y la temperatura final del calorímetro es
y la temperatura final del calorímetro es ![]() .
.
a) Se tienen 200 g de cobre a ![]() . ¿Qué cantidad de calor se necesita para elevarlos hasta
. ¿Qué cantidad de calor se necesita para elevarlos hasta ![]() ?
?
b) Si se tienen 200 g de aluminio a ![]() y se les suministra la misma cantidad de calor que al cobre, ¿cuál estará más caliente?
y se les suministra la misma cantidad de calor que al cobre, ¿cuál estará más caliente?
Datos: ![]() ;
; ![]()
Un cuerpo de 200 g que está a una temperatura de ![]() se introduce dentro de un calorímetro de
se introduce dentro de un calorímetro de ![]() que contiene 500 g de agua a
que contiene 500 g de agua a ![]() . Si la temperatura de equilibrio resulta de
. Si la temperatura de equilibrio resulta de ![]() , calcula el calor específico del cuerpo.
, calcula el calor específico del cuerpo.
Se calentó una muestra de 25 g de una aleación hasta ![]() y se sumergió en un recipiente con 90 g de agua a
y se sumergió en un recipiente con 90 g de agua a ![]() . La temperatura del agua aumentó hasta un valor final de
. La temperatura del agua aumentó hasta un valor final de ![]() . Despreciando las pérdidas caloríficas hacia el ambiente y la capacidad calorífica del recipiente, ¿cuál es el calor específico de la aleación?
. Despreciando las pérdidas caloríficas hacia el ambiente y la capacidad calorífica del recipiente, ¿cuál es el calor específico de la aleación?
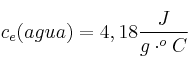
Se determina el calor específico de una sustancia C en un calorímetro que tiene inicialmente 200 g de agua a ![]() . Si la muestra de C tiene una masa de 89 g y su temperatura inicial es de
. Si la muestra de C tiene una masa de 89 g y su temperatura inicial es de ![]() , ¿cuál es su calor específico si la temperatura de equilibrio es de
, ¿cuál es su calor específico si la temperatura de equilibrio es de ![]() ?
?
Calor específico del agua: ![]() .
.
Un trozo de cobre de 1.2 kg y calor específico ![]() , a la temperatura de
, a la temperatura de ![]() , se sumerge en un recipiente metálico, de masa 0.30 kg, que contiene
, se sumerge en un recipiente metálico, de masa 0.30 kg, que contiene ![]() de agua a la temperatura de
de agua a la temperatura de ![]() . Si la temperatura de equilibrio de la mezcla es de
. Si la temperatura de equilibrio de la mezcla es de ![]() y consideramos que el calor específico del agua es
y consideramos que el calor específico del agua es ![]() :
:
a) ¿Cuántos sistemas están involucrados en esta mezcla? De ellos indica claramente quién cede y quién absorbe calor.
b) Escribe, de forma literal, el principio de mezclas para este ejercicio.
c) Calcula el calor específico del metal que constituye el recipiente, realizando las transformaciones de unidades que necesites.
Determina la cantidad de energía necesaria para calentar un recipiente con 1.5 L de agua desde los ![]() hasta los
hasta los ![]() .
.
Datos: ![]() ;
; ![]()
Calcula qué cantidad de energía hay que suministrar a 1 350 mL de agua a ![]() para convertirlos en vapor de agua a
para convertirlos en vapor de agua a ![]() .
.
Datos: ![]() ;
; ![]() ;
; ![]()
 Ejercicios FyQ
Ejercicios FyQ