1.3. Tipos de nomenclatura
NOMENCLATURA DE COMPOSICIÓN.
También es llamada nomenclatura estequiométrica. Esta forma de nombrar está basada en qué tipo de átomos componen la molécula o compuesto. Esta nomenclatura sólo da información sobre qué tipo de átomos están en la sustancia y en qué proporción están.
La proporción en la que se encuentran los distintos átomos se puede expresar usando lo prefijos numerales, los números de oxidación e incluso el número de carga (para compuestos iónicos).
Veamos algunos ejemplos:
| Fórmula | Nombre (Prefijos) |
Nombre (Nº Oxidación) |
Nombre (Nº Carga) |
| Hg2Cl2 | Dicloruro de dimercurio |
Cloruro de mercurio(I) | Cloruro de mercurio(1+) |
| PCl5 | Pentacloruro de fósforo | Cloruro de fósforo(V) |
- |
| Fe2O3 | Trióxido de dihierro | Óxido de hierro(III) |
Óxido de hierro(3+) |
Observa que no procede el nombre con el número de carga en el compuesto que no es iónico.
Escribe los nombres o fórmulas de los siguientes compuestos (usa sólo minúsculas para los nombres). En cada cuadro blanco sólo una palabra.
a) tricloruro de boro:
b) : CH4
c) óxido de oro(III):
d) (1+): NaCl
NOMENCLATURA DE ADICIÓN.
Esta forma de nombrar considera un átomo central al que se unen los demás átomos (o grupos de átomos) como si fueran ligandos. Esta nomenclatura es especialmente útil para nombrar los oxocompuestos. Los átomos considerados como ligandos se deben nombrar por orden alfabético y usando los prefijos numerales. No se usan los números de oxidación.
| Fórmula | Nombre |
| Si(OH)4 | Tetrahidróxido de silicio |
| OCl2 | Dicloruro de oxígeno |
| OClF | Fluoruroóxido de cloro |
Fíjate en que este tipo de nomenclatura es muy similar a la de composición pero prescindiendo de las referencias a los estados de oxidación o números de carga. Es imporante señalar también que en los oxocompuestos (como es el caso del OClF) usaremos "óxido" a la hora de nombrar y es una gran diferencia con respecto a nomenclaturas obsoletas.
NOMENCLATURA DE SUSTITUCIÓN.
El origen de esta nomenclatura son los hidruros no metálicos, que son nombrados como los hidrocarburos y usando los sufijos que fueran necesarios. Vamos a poner en una tabla los nombres que la IUPAC da a estos compuestos de partida:
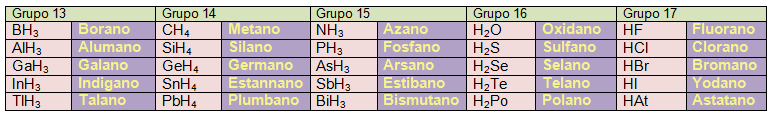
La IUPAC sigue aceptando, como no podía ser de otro modo, los nombres de amoniaco para el NH3 y agua para el H2O.
En el caso de hidruros de estos elementos pero con otros estados de oxidación, habrá que nombrarlos usando la letra griega lambda con un superíndice que indique el estado de oxidación y unido al nombre del compuesto de partida con un guión. Observa los siguientes ejemplos:
| Fórmula | Nombre de sustitución |
| PH5 | λ5-fosfano |
| SnH2 | λ2-estannano |
| H6S | λ6-sulfano |
| PbH2 | λ2-plumbano |
Puede ocurrir que tengamos una molécula formada por dos o más átomos no metálicos unidos entre sí. En ese caso debemos usar los prefijos numerales para nombrar el compuesto. Veamos algunos ejemplo:
- H2O2: Se puede escribir como HO-OH y su nombre será dioxidano.
- N2H4: Su fórmula semidesarrollada sería H2N-NH2 y su nombre de sustitución será diazano.
- H2S4: Podríamos escribirlo como HS-S-S-SH y su nombre es tetrasulfano.
Otra posibilidad sería que entre los átomos no metálicos se establecieran dobles o triples enlaces. En ese caso haremos uso de los sufijos que se usa en la nomenclatura orgánica: -eno para los dobles enlaces e -ino para los triples.
- HN=NH: Su nombre es diazeno.
- HSi≡SiH: Su nombre es disilino.
Por último vemos cómo se nombrarían compuestos en los que ha sido sustituido alguno de los hidrógenos por otro tipo de átomos. Más adelante profundizaremos un poco más en este apartado:
- NHCl2: Dicloroazano
- PH2Br: Bromofosfano
- OCl2: Diclorooxidano
La conclusión que podemos obtener es que no existe un único nombre para cada compuesto sino que depende del tipo de nomenclatura que adoptemos. Si un nombre describe un compuesto de manera inequívoca y suficiente diremos que es correcto.
Es impotante evitar mezclar la forma de nombrar en cada una de las nomenclaturas explicadas para no llegar a nombres incorrectos. A lo largo del tema iremos viendo qué nomenclatura es más cómoda para cada tipo de compuesto.
