El ![]() reacciona con el
reacciona con el ![]() a altas temperaturas según:
a altas temperaturas según:
![]()
Se introducen 4,4 g de
a) El número de moles de cada una de las especies en equilibrio.
b) El valor de las constantes ![]() y
y ![]() a esa temperatura.
a esa temperatura.
Datos: C = 12; O = 16; 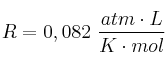
Problemas, cuestiones y ejercicios sobre equilibrio químico para alumnos de 2.º de Bachillerato.
El ![]() reacciona con el
reacciona con el ![]() a altas temperaturas según:
a altas temperaturas según:
![]()
a) El número de moles de cada una de las especies en equilibrio.
b) El valor de las constantes ![]() y
y ![]() a esa temperatura.
a esa temperatura.
Datos: C = 12; O = 16; 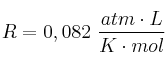
Considera el siguiente sistema en equilibrio:
![]()
a) Aumento de la temperatura (sobre el valor de ![]() ).
).
b) Adición de ![]() (sobre la cantidad de
(sobre la cantidad de ![]() ).
).
c) Aumento de la presión (sobre la cantidad de CO).
A la temperatura de 400 ºC y 710 mm Hg de presión, el amoniaco se encuentra disociado en un ![]() según la ecuación:
según la ecuación:
![]()
a) La presión parcial de cada uno de los gases que constituyen la mezcla en equilibrio.
b) El valor de las constantes ![]() y
y ![]() a esas temperaturas.
a esas temperaturas.
(Dato: 1 atm = 760 mm Hg)
El fosgeno, ![]() , usado en la preparación de poliuretano, se obtiene a partir del
, usado en la preparación de poliuretano, se obtiene a partir del ![]() según la reacción:
según la reacción:
![]()
Una mezcla en equilibrio a ![]() contiene 0.01 moles de
contiene 0.01 moles de ![]() y 0.02 moles de
y 0.02 moles de ![]() por litro, así como cierta cantidad de
por litro, así como cierta cantidad de ![]() .
.
a) Si la ![]() de formación del fosgeno, a esa temperatura, vale
de formación del fosgeno, a esa temperatura, vale ![]() , ¿cuál es la concentración de
, ¿cuál es la concentración de ![]() ?
?
b) Calcula el valor de ![]() de la reacción anterior a esa temperatura.
de la reacción anterior a esa temperatura.
c) ¿Cuánto valdrá la constante ![]() de la descomposición del fosgeno a esa temperatura?
de la descomposición del fosgeno a esa temperatura?
El hidrogenocarbonato sódico se descompone a 120 ºC según el equilibrio:
![]()
a) ![]() y
y ![]() para este equilibrio a 120 ºC.
para este equilibrio a 120 ºC.
b) La composición en peso de la mezcla gaseosa en el equilibrio.