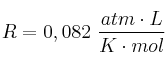Para el equilibrio ![]() , la constante de equilibrio
, la constante de equilibrio ![]() es 54,8 a la temperatura de 425 ºC. Calcula:
es 54,8 a la temperatura de 425 ºC. Calcula:
a) Las concentraciones de todas las especies en el equilibrio si se calientan, a la citada temperatura, 0,60 moles de HI y 0,10 moles de ![]() en un recipiente de un litro de capacidad.
en un recipiente de un litro de capacidad.
b) El porcentaje de disociación del HI.
 EjerciciosFyQ
EjerciciosFyQ