A 613 K, el valor de la constante de equilibrio es ![]() para la reacción:
para la reacción:
![]()
Si en el equilibrio anterior la presión parcial del hidrógeno es una atmósfera, calcula:
a) La concentración de hidrógeno.
b) La presión total.
Problemas, cuestiones y ejercicios sobre equilibrio químico para alumnos de 2.º de Bachillerato.
A 613 K, el valor de la constante de equilibrio es ![]() para la reacción:
para la reacción:
![]()
Si en el equilibrio anterior la presión parcial del hidrógeno es una atmósfera, calcula:
a) La concentración de hidrógeno.
b) La presión total.
En una vasija de 10 L mantenida a 270 ºC y previamente evacuada se introducen 2,5 moles de pentacloruro de fósforo y se cierra herméticamente. La presión en el interior comienza entonces a elevarse debido a la disociación térmica del pentacloruro: ![]() . Cuando se alcanza el equilibrio la presión es de 15,6 atm.
. Cuando se alcanza el equilibrio la presión es de 15,6 atm.
a) Calcula el número de moles de cada especie en el equilibrio.
b) Obtén los valores de ![]() y
y ![]() .
.
Dato: 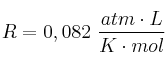
En un vaso de agua se pone una cierta cantidad de una sal poco soluble, de fórmula general ![]() y no se disuelve completamente. El producto de solubilidad de la sal es
y no se disuelve completamente. El producto de solubilidad de la sal es ![]() :
:
a) Deduce la expresión que relaciona la concentración molar de ![]() con el producto de solubilidad de la sal.
con el producto de solubilidad de la sal.
b) Si se añade una cantidad de sal muy soluble de ![]() . Indica razonadamente la variación que se produce en la solubilidad de la sal
. Indica razonadamente la variación que se produce en la solubilidad de la sal ![]() .
.
c) Si B es el ion ![]() ¿Cómo influye la disminución del pH en la solubilidad del compuesto?
¿Cómo influye la disminución del pH en la solubilidad del compuesto?
A cierta temperatura el producto de solubilidad en agua del AgI es ![]() . Para esa temperatura, calcula la solubilidad molar del compuesto en:
. Para esa temperatura, calcula la solubilidad molar del compuesto en:
a) Una disolución 0.1 M de ![]() .
.
b) Una disolución de ácido yodhídrico de pH = 2
La descomposición del pentaóxido de dinitrógeno se puede describir como: ![]()
a) Escribe las expresiones de ![]() y
y ![]() .
.
b) ¿Explica cómo evoluciona el equilibrio si se aumenta la presión del sistema?
c) ¿Cómo afectaría al equilibrio un aumento de la concentración de oxígeno? ¿Y al valor de ![]() ?
?