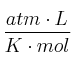Para la siguiente reacción exotérmica en el equilibrio:
![]()
Razona cuál es el efecto sobre la concentración de HCl en el equilibrio en los siguientes casos:
a) Aumento de la concentración de ![]()
b) Disminución de la concentración de ![]()
c) Aumento del volumen del sistema.
d) Reducción de la temperatura del sistema.
e) Añadir un gas inerte como He.
f) Introducir un catalizador positivo.
 EjerciciosFyQ
EjerciciosFyQ