¿Qué relación tiene la combustión con la física?
Ejercicios y problemas de Termoquímica para 2.º de Bachillerato.
¿Qué relación tiene la combustión con la física?
Un frasco contiene 120 g de nitrógeno a 3 atm de presión y ![]() de temperatura. Se le calienta manteniendo el volumen constante, hasta alcanzar la temperatura de
de temperatura. Se le calienta manteniendo el volumen constante, hasta alcanzar la temperatura de ![]() . Calcula:
. Calcula:
a) El calor suministrado.
b) El trabajo realizado.
c) El incremento de energía interna.
d) La presión final.
Dato: ![]()
Un gas se expande realizando un trabajo de ![]() a una presión constante de
a una presión constante de ![]() . Si el gas ocupa inicialmente un volumen de
. Si el gas ocupa inicialmente un volumen de ![]() , ¿cuál será su volumen final?
, ¿cuál será su volumen final?
Un recipiente que contiene 2 kg de agua se coloca en una estufa caliente y el contenido se agita violentamente por medio de un mezclador que realiza un trabajo mecánico de 6 kJ sobre el agua. La temperatura del agua de eleva en ![]() . ¿Qué cantidad de calor fluyó hacia el agua desde la estufa durante el proceso?
. ¿Qué cantidad de calor fluyó hacia el agua desde la estufa durante el proceso?
Calor específico del agua: 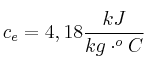
Una bomba succiona agua a una presión de 1 bar y la descarga a 8 bar. Despreciando los cambios de densidad, velocidad y altura del agua, estima el trabajo por unidad de masa requerido. Supón que el proceso se desarrolla sin fricción y que la densidad del agua es de ![]()