Utilizando los datos que se facilitan, indica razonadamente si:
a) El Mg(s) desplazará al ![]() en disolución acuosa.
en disolución acuosa.
b) El Sn(s) reaccionará con una disolución acuosa de HCl 1 M disolviéndose.
c) El ![]() oxidará al
oxidará al ![]() en disolución ácida a
en disolución ácida a ![]() .
.
Datos: ![]() ;
; ![]() ;
; ![]() ;
; ![]() ;
; ![]() ;
; ![]()
Se desean sintetizar 150 g de anilina a partir de nitrobenceno. Sabiendo que solo el ![]() del nitrobenceno se transforma en anilina en la reacción:
del nitrobenceno se transforma en anilina en la reacción:
![]()
a) Realiza el ajuste de la ecuación por el método ion-electrón.
b) Identifica el agente reductor y el agente oxidante.
c) Calcula las masas de nitrobenceno, NaOH y de ![]() que serán necesarias para obtener la masa deseada de anilina.
que serán necesarias para obtener la masa deseada de anilina.
Datos en 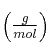 : H = 1 ; C = 12 ; S = 32 ; N = 14 ; O = 16 ; Na = 23.
: H = 1 ; C = 12 ; S = 32 ; N = 14 ; O = 16 ; Na = 23.
Sin utilizar tablas de potenciales de reducción escribe las siguientes semirreacciones:
a) Reducción del manganeso en el ![]() , a
, a ![]() en medio ácido.
en medio ácido.
b) Oxidación del oxígeno del ![]() en medio ácido.
en medio ácido.
c) Reducción del azufre sólido en medio ácido.
d) Oxidación del azufre del ![]() a
a ![]() en medio alcalino.
en medio alcalino.
e) Reducción del ![]() en medio alcalino.
en medio alcalino.
Para platear un objeto se ha estimado que es necesario depositar 40 g de plata.
a) Si se realiza la electrolisis de una disolución acuosa de sal de plata con una corriente de 2 amperios, ¿cuánto tiempo se tardará en realizar el proceso?
b) ¿Cuántos moles de electrones han sido necesarios para ello?
Datos: F =96 500 C ; Ag =108.
Calcula el tiempo necesario para que una intensidad de corriente constante de 1.2 A deposite 0.500 g de:
a) ![]() como elemento en un cátodo.
como elemento en un cátodo.
b) ![]() como
como ![]() en un ánodo.
en un ánodo.
c) ![]() como elemento en un cátodo.
como elemento en un cátodo.
Indica si son verdaderas o falsas las siguientes proposiciones, para el caso de una cuba electrolítica:
a) En el cátodo ocurre la oxidación.
b) En el ánodo ocurre la oxidación.
c) Los cationes fluyen hacia el cátodo.
d) En el ánodo los aniones ceden electrones.
Indica si las siguientes afirmaciones son verdaderas o falsas en relación al siguiente proceso:
![]()
a) El estaño se oxida.
b) El ácido nítrico es el agente oxidante.
c) La forma reducida es el dióxido de nitrógeno.
d) El coeficiente del agente reductor es 4.
¿Qué volumen de solución 0.1000 N de ![]() se necesitaría para valorar 0.1980 g de oxalato de sodio con una pureza del
se necesitaría para valorar 0.1980 g de oxalato de sodio con una pureza del ![]() ?
?
El ![]() reacciona con el
reacciona con el ![]() según el proceso:
según el proceso:
![]()
¿Cuántos litros de ![]() , en condiciones normales, se obtienen a partir de 50 g de
, en condiciones normales, se obtienen a partir de 50 g de ![]() ?
?
(Datos: K = 39 ; Br = 80)
 Ejercicios FyQ
Ejercicios FyQ