-
Ley de Dalton: Presión parcial de los gases de una mezcla (7512)
La presión medida en un recipiente, que contiene una mezcla de tres gases, es de 1.5 atm. Las masas de los gases contenidos son 84 g de 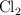 , 0.6 g de
, 0.6 g de 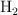 y 0.6 g de Ar. ¿Cuál es la presión parcial de cada gas dentro del recipiente?
y 0.6 g de Ar. ¿Cuál es la presión parcial de cada gas dentro del recipiente?
Masas atómicas: Cl = 35.5 ; H = 1 ; Ar = 40.
-
Variación de la presión manométrica de un balón con la temperatura (7255)
Un balón de fútbol recibe una presión atmosférica de 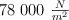 y se infla a una presión manométrica de
y se infla a una presión manométrica de 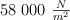 , registrando una temperatura de
, registrando una temperatura de 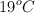 . Si el balón recibe un incremento en su temperatura a
. Si el balón recibe un incremento en su temperatura a  debido a los rayos solares, calcula:
debido a los rayos solares, calcula:
a) ¿Cuál será su presión absoluta?
b) ¿Cuál será su presión manométrica?
-
Masa de oxígeno introducida en un recipiente que contiene metano (6955)
En un recipiente tenemos 28 g de metano ejerciendo una presión de 1 atm. Sin variar el volumen ni la temperatura se introduce oxígeno y la presión asciende a 1.5 atm. ¿Qué cantidad de oxígeno se ha introducido?
-
Presión parcial de cada gas en una mezcla (6941)
La masa molar aparente de una mezcla gaseosa compuesta por 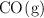 y
y 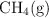 es 22.4 g/mol. Si 10 moles de la mezcla ocupan un volumen de 4.2 L a
es 22.4 g/mol. Si 10 moles de la mezcla ocupan un volumen de 4.2 L a 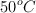 . Determina la presión parcial de cada gas.
. Determina la presión parcial de cada gas.
-
Temperatura a la que hay que calentar un gas para vencer una presión externa (6788)
Un cilindro, que tiene un radio de 40 cm y 50 cm de profundidad, se llena con aire a 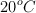 y 1 atm. Luego sobre el cilindro baja un pistón de 20 kg, y comprime el aire atrapado en el interior mientras llega a una altura de equilibrio
y 1 atm. Luego sobre el cilindro baja un pistón de 20 kg, y comprime el aire atrapado en el interior mientras llega a una altura de equilibrio 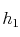 . Para finalizar, un perro de 35 kg se pone sobre el pistón y comprime más el aire, que permanece a
. Para finalizar, un perro de 35 kg se pone sobre el pistón y comprime más el aire, que permanece a 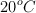 .
.
a) ¿Qué distancia se mueve el émbolo cuando el perro se coloca encima de él?
b) ¿A qué temperatura se calienta el gas para elevar el pistón y al perro de regreso hasta 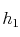 ?
?
 Leyes de los gases
Leyes de los gases