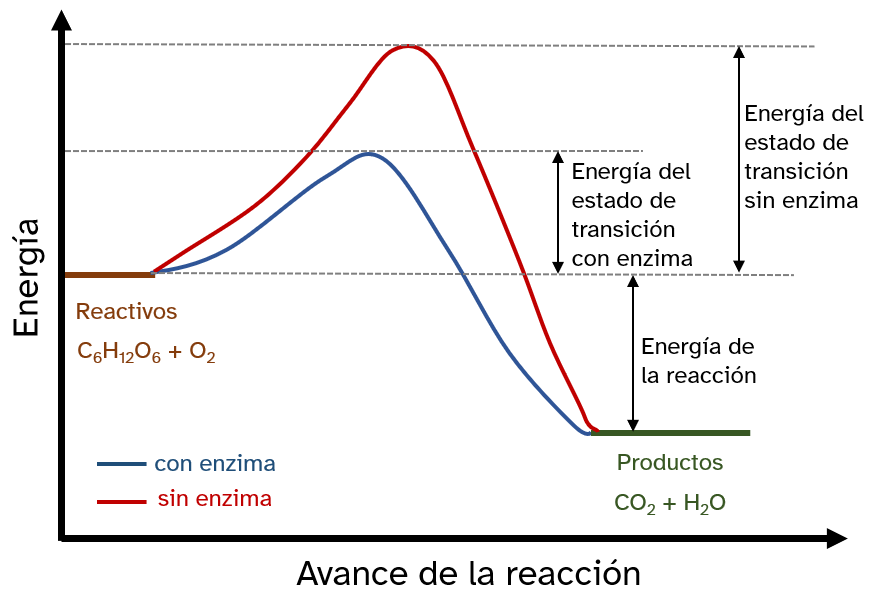
A partir de la gráfica razona si cada una de las afirmaciones es verdadera o falsa:
a) El catalizador facilita la formación del complejo activado.
b) El catalizador disminuye la energía del estado de transición.
c) El catalizador no produce disminución en la energía de activación.
d) La energía de activación de los reactivos es menor que la energía de activación de los productos.
La urea (![]() ) es el producto final del metabolismo de las proteínas de los animales. La urea se descompone en medio ácido según la reacción:
) es el producto final del metabolismo de las proteínas de los animales. La urea se descompone en medio ácido según la reacción:
![]()
Esta reacción es de primer orden respecto a la urea y su velocidad no depende de otros reactivos. Cuando la concentración de urea es de 0.200 M, la velocidad de la reacción a ![]() es
es ![]() .
.
a) ¿Cuál es el valor de la constante de velocidad a esta temperatura?
b) Si la concentración inicial de urea es 0.500 M, ¿cuál sería su concentración después de 1 hora?
c) ¿Cuál es la vida media de la urea a ![]() ?
?
A un proceso le añadimos un catalizador negativo. Razona si las siguientes afirmaciones son verdaderas o falsas:
a) La variación de energía del proceso es negativa.
b) El orden total de reacción disminuye.
c) La velocidad de reacción disminuye.
d) Se modifica el mecanismo de reacción.
Se han realizado cuatro medidas con distintos valores de concentración inicial, a ![]() , para estudiar la cinética de la reacción:
, para estudiar la cinética de la reacción:
![]()
![\begin{tabular}{| c | c | c | c | } \hline Exp&[A]_0 (M)&[B]_0 (M)&v (M\cdot s^{-1})\\\hline 1 &0.20&0.20&1.1\cdot 10^{-6}\\\hline 2&0.40&0.20&4.4\cdot 10^{-6}\\\hline 3&0.20&0.60&3.3\cdot 10^{-6}\\\hline 4&0.20&1.20&6.6\cdot 10^{-6}\\\hline \end{tabular} \begin{tabular}{| c | c | c | c | } \hline Exp&[A]_0 (M)&[B]_0 (M)&v (M\cdot s^{-1})\\\hline 1 &0.20&0.20&1.1\cdot 10^{-6}\\\hline 2&0.40&0.20&4.4\cdot 10^{-6}\\\hline 3&0.20&0.60&3.3\cdot 10^{-6}\\\hline 4&0.20&1.20&6.6\cdot 10^{-6}\\\hline \end{tabular}](local/cache-TeX/10550461878d1fda71db37705cf1438d.png)
Escribe la ecuación de velocidad de la reacción y calcula su constante de velocidad.
El mármol puede reaccionar con el ácido acético según la reacción:
![]()
Sabiendo que se trata de una reacción débilmente exotérmica, explica dos maneras de aumentar la velocidad de reacción del proceso.
Si el tiempo de vida media de una reacción de segundo orden es 60.0 s, y la concentración inicial es 0.800 M, ¿cuál era la concentración a los 20.0 s?
Si el tiempo de vida media de una reacción de primer orden es 25.0 s, ¿cuál era la concentración cuando habían transcurrido 8.00 s si la concentración inicial era de 0.500 M?
Una reacción hipotética que convierte el reactivo A en producto P es de orden 2 respecto al reactivo. Si se parte de una concentración de A igual a 0.123 M y se determina que al cabo de 10 minutos la concentración de A es de 0.090 M, determina:
a) El valor de la constante de velocidad.
b) La concentración de A después de transcurridos 60 s.
Para una determinada reacción, ![]() , se ha medido la velocidad a partir de distintas concentraciones iniciales de A y se han registrado los resultados en la tabla:
, se ha medido la velocidad a partir de distintas concentraciones iniciales de A y se han registrado los resultados en la tabla:
![\begin{tabular}{| c | c | } \hline [A] (M)&v (M\cdot s^{-1})\\\hline 0.1&0.15\\\hline 0.2&1.2\\\hline 0.3&4.05\\\hline \end{tabular} \begin{tabular}{| c | c | } \hline [A] (M)&v (M\cdot s^{-1})\\\hline 0.1&0.15\\\hline 0.2&1.2\\\hline 0.3&4.05\\\hline \end{tabular}](local/cache-TeX/45abba4222ed10a7ba933cdf94fb6068.png)
Calcula el orden de reacción y la constante de velocidad.
Explica de forma razonada por qué un aumento de la temperatura provoca un aumento mucho mayor de la velocidad de reacción.
 Ejercicios FyQ
Ejercicios FyQ