El carbamato de amonio 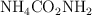 es una sustancia de uso común (como fertilizante) con un equilibrio sólido-vapor que ha sido ampliamente estudiado desde mediados del siglo XIX y que actualmente está considerado como la base de la tecnología más avanzada (SCR, reducción catalítica selectiva) para la reducción de emisiones de óxidos de nitrógeno en motores diesel exigida por las nuevas legislaciones internacionales:
es una sustancia de uso común (como fertilizante) con un equilibrio sólido-vapor que ha sido ampliamente estudiado desde mediados del siglo XIX y que actualmente está considerado como la base de la tecnología más avanzada (SCR, reducción catalítica selectiva) para la reducción de emisiones de óxidos de nitrógeno en motores diesel exigida por las nuevas legislaciones internacionales:
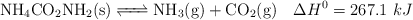
Para determinar su grado de disociación hasta alcanzarse dicho equilibrio se introducen 75.0 gramos de carbamato de amonio en un recipiente hermético de 750 mL. El equilibrio se alcanza a una temperatura constante de 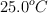 , registrándose una presión de 0.116 atm y un valor de
, registrándose una presión de 0.116 atm y un valor de 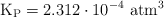 .
.
a) Determina el grado de disociación del carbamato de amonio.
b) Determina las concentraciones de todas las especies en el equilibrio.
c) Determina el valor de 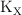 .
.
d) ¿Hacia dónde se desplazará la reacción hasta alcanzar un nuevo equilibrio si se incrementa la temperatura?
![]() gaseoso,
gaseoso, ![]() , la constante de equilibrio
, la constante de equilibrio ![]() vale 2.49 a
vale 2.49 a ![]() .
.![]() a esa temperatura y las presiones parciales de las especies en el equilibrio.
a esa temperatura y las presiones parciales de las especies en el equilibrio.![]() .
.![]()
 EjerciciosFyQ
EjerciciosFyQ