-
Estequiometría en la formación del amoniaco (2768)
En el proceso de formación del amoniaco, el 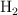 reacciona con el
reacciona con el 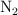 y produce
y produce 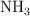 , a 400 grados centígrados y 630 torr. Calcula los moles de amoniaco que se producen al reaccionar 13.6 g de nitrógeno.
, a 400 grados centígrados y 630 torr. Calcula los moles de amoniaco que se producen al reaccionar 13.6 g de nitrógeno.
-
Reacción química entre oxígeno y sodio 0001
El sodio y el oxígeno reaccionan para dar lugar al óxido de sodio.
a) Escribe y ajusta la reacción.
b) Calcula la masa de sodio necesaria para obtener 75 g de óxido de sodio.
c) Calcula el volumen de oxígeno necesario, a 1,3 atm y 25 ºC, para obtener 48 g de óxido de sodio.
d) ¿Qué tipo de reacción es la que se produce?
Datos: Na = 23 ; O = 16 ; 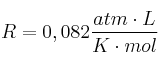
-
Reacción química entre oxígeno y potasio 0001
El potasio y el oxígeno reaccionan para dar lugar al óxido de potasio.
a) Escribe y ajusta la reacción.
b) Calcula la masa de óxido de potasio que se obtendrá si hacemos reaccionar 45 g de potasio con exceso de oxígeno.
c) Calcula el volumen de oxígeno necesario, a 1 atm y 27 ºC, para obtener 32 g de óxido de potasio.
d) ¿Qué tipo de reacción es la que se produce?
Datos: K = 39 ; O = 16 ; 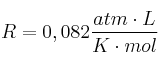
-
Masa de producto y estequiometría 0002
El hierro se puede oxidar según la reacción química sin ajustar: 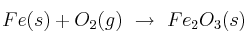 . Si se obtuvieron 34 g del óxido de hierro:
. Si se obtuvieron 34 g del óxido de hierro:
a) ¿Qué masa de hierro reaccionó?
b) ¿Cuántos litros de oxígeno, en condiciones normales, fueron necesarios en la reacción?
Datos: Fe = 56 ; O = 16
-
Reacciones químicas: relación másica entre sustancias 0001
Responde a las preguntas sobre la reacción: 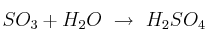 :
:
a) ¿Qué masa de 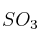 reacciona con 0,65 g de
reacciona con 0,65 g de 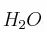 ?
?
b) ¿Cuántos mol de 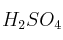 se obtienen al reaccionar 0,65 g de
se obtienen al reaccionar 0,65 g de 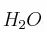 ?
?
Masas atómicas: H = 1; O = 16; S = 32