Estudio de una reacción química 0001
El dióxido de carbono( ) se encuentra en la atmósfera como producto de la respiración de animales y vegetales. Se produce también en las combustiones, en los procesos de fermentación y en las emanaciones volcánicas.
) se encuentra en la atmósfera como producto de la respiración de animales y vegetales. Se produce también en las combustiones, en los procesos de fermentación y en las emanaciones volcánicas.
Es un gas incoloro, inodoro y de sabor picante, mucho más denso que el aire. Las bebidas gaseosas, las cervezas, la soda, los vinos espumosos, contienen dióxido de carbono disuelto a presión.
En el laboratorio se puede obtener descomponiendo el carbonato de calcio(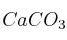 ) por acción del ácido clorhídrico formándose dióxido de carbono, cloruro de calcio y agua. Se puede reconocer haciéndolo burbujear en agua de cal (hidróxido de calcio) formándose un precipitado blanco de carbonato de calcio.
) por acción del ácido clorhídrico formándose dióxido de carbono, cloruro de calcio y agua. Se puede reconocer haciéndolo burbujear en agua de cal (hidróxido de calcio) formándose un precipitado blanco de carbonato de calcio.
De acuerdo con lo dicho en el texto:
a) Plantea la ecuación de obtención para el dióxido de carbono.
b) Indica los estados de agregación de los reactivos y productos.
c) Indica el número de reactivos y productos presentes en la ecuación química.
d) Di si es falsa o verdadera, justificándolo con datos, la siguiente afirmación: La suma de las masas molares de los reactivos es 124g.
e) Si quisieras obtener 44 g de dióxido de carbono, ¿cuántos gramos de cada uno de los reactivos necesitarías? Justifica la respuesta.