Calcular el calor que requiere una máquina térmica con una eficiencia del
![]() si desarrolla un trabajo de 6 000 J.
si desarrolla un trabajo de 6 000 J.
Calcula la entalpía molar de la reacción de combustión del propano sabiendo que, al quemarse completamente 50 g de propano, el calor liberado hace que aumente la temperatura de 10 kg de agua desde ![]() hasta
hasta ![]() .
.
Datos: ![]() ; C = 12 ; H = 1.
; C = 12 ; H = 1.
Un horno de cocina eléctrico tiene un área de pared total de ![]() y está aislado con una capa de fibra de vidrio de
y está aislado con una capa de fibra de vidrio de ![]() de espesor. La superficie interior de la fibra de vidrio está a
de espesor. La superficie interior de la fibra de vidrio está a ![]() , mientras que la exterior está a
, mientras que la exterior está a ![]() . La fibra de vidrio tiene una conductividad térmica de
. La fibra de vidrio tiene una conductividad térmica de ![]() . Calcula:
. Calcula:
a) La corriente de calor en el aislante, tratándolo como una placa plana con un área de ![]() .
.
b) ¿Qué aporte de potencia eléctrica requiere el elemento calentador para mantener esta temperatura?
Un bloque de hielo de 40 g se enfría hasta los ![]() y luego se agrega a 590 g de agua en un calorímetro de cobre de 80 g a una temperatura de
y luego se agrega a 590 g de agua en un calorímetro de cobre de 80 g a una temperatura de ![]() . Calcula el calor total necesario para fundir el hielo a su temperatura de fusión y explica si dentro del calorímetro, con el agua añadida, es posible que se complete el cambio de estado.
. Calcula el calor total necesario para fundir el hielo a su temperatura de fusión y explica si dentro del calorímetro, con el agua añadida, es posible que se complete el cambio de estado.
Datos: ![]() ;
; ![]() ;
; ![]() ;
; ![]()
Una esfera de cobre a ![]() tiene una masa de 200 g y es lanzada verticalmente hacia arriba con una velocidad de 210 m/s. Cuando regresa al punto de partida choca con una esfera de hielo a
tiene una masa de 200 g y es lanzada verticalmente hacia arriba con una velocidad de 210 m/s. Cuando regresa al punto de partida choca con una esfera de hielo a ![]() . Suponiendo que toda la energía de la colisión se transforma en calor y que no cambia la temperatura de la esfera de cobre, ¿qué masa, expresada en gramos, de hielo se funde?
. Suponiendo que toda la energía de la colisión se transforma en calor y que no cambia la temperatura de la esfera de cobre, ¿qué masa, expresada en gramos, de hielo se funde?
Una esfera de acero tiene un diámetro de 2.5 cm a ![]() . ¿Qué cambio de temperatura se requiere para que su volumen se incremente un
. ¿Qué cambio de temperatura se requiere para que su volumen se incremente un ![]() ?
?
Dato: ![]()
Se tienen 0.5 kg de hielo a ![]() y se mezclan con una masa de agua desconocida a
y se mezclan con una masa de agua desconocida a ![]() . Calcula la masa de agua que debemos mezclar para que quede toda líquida a
. Calcula la masa de agua que debemos mezclar para que quede toda líquida a ![]() ?
?
Datos: ![]() ;
; ![]() ;
; ![]()
Calcula qué cantidad de agua a ![]() se necesita para fundir completamente 200 g de hielo a
se necesita para fundir completamente 200 g de hielo a ![]() .
.
Datos: ![]() ;
; ![]()
Un congelador enfría por evaporación de ![]() líquido. ¿Qué masa de este líquido será necesaria evaporar para congelar 525 g de agua líquida a
líquido. ¿Qué masa de este líquido será necesaria evaporar para congelar 525 g de agua líquida a ![]() ? El calor de fusión del hielo es
? El calor de fusión del hielo es ![]() y el calor de vaporización del
y el calor de vaporización del ![]() es
es ![]() .
.
En una empresa se funde plomo utilizando un crisol y un quemador de gas licuado de petróleo (GLP). El crisol es de hierro fundido, tiene una masa de 60 kg y una capacidad para fundir 300 kg de plomo.
Se requiere calcular la cantidad de calor necesario para fundir una carga de plomo y el volumen, expresado en litros, de GLP que se consume. Considera que la temperatura inicial del sistema crisol-plomo es de ![]()
Datos: 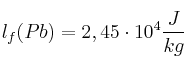 ;
; ![]() ;
; 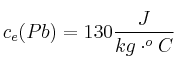 ;
; 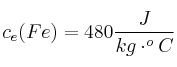 ;
; 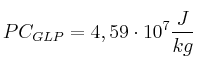 ;
; 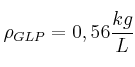
 Ejercicios FyQ
Ejercicios FyQ