¿Cuántos gramos de hielo a ![]() se fundirán en 1,05 kg de agua a una temperatura de
se fundirán en 1,05 kg de agua a una temperatura de ![]() ?
?
Datos: 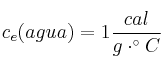 ;
; 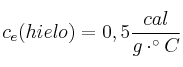 ;
; 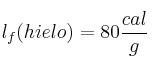
Se tiene 0.3 kg de agua a ![]() y quiero enfriarlos hasta los
y quiero enfriarlos hasta los ![]() con hielo que está a
con hielo que está a ![]() . ¿Qué masa de hielo le debo agregar al agua?
. ¿Qué masa de hielo le debo agregar al agua?
Datos: ![]() ;
; ![]() ;
; ![]()
Se tiene un cuadrado de cobre, aislado térmicamente, de 100 cm de arista y de 3 cm de espesor. Si en el exterior se mantiene una temperatura constante de ![]() y en el interior se pone hielo a
y en el interior se pone hielo a ![]() , ¿cuál será la masa del hielo fundido en 1 000 s?
, ¿cuál será la masa del hielo fundido en 1 000 s?
Conductividad térmica del cobre: ![]() ;
; ![]()
Para calentar agua para preparar una taza de café se usa un calentador de inmersión pequeño. Queremos utilizarlo para calentar 238 mL de agua (una taza llena) de ![]() a
a ![]() en 2.00 minutos. ¿Cuál debe ser la rapidez de calentamiento del calentador, en KJ/min, para lograrlo? Omite el calor que consume la taza para calentarse. La densidad del agua es de 0.997 g/mL.
en 2.00 minutos. ¿Cuál debe ser la rapidez de calentamiento del calentador, en KJ/min, para lograrlo? Omite el calor que consume la taza para calentarse. La densidad del agua es de 0.997 g/mL.
Se realiza un experimento dividiendo un sólido de estructura uniforme en dos partes, con masas diferentes. Se proporciona a ambas masas la misma cantidad de calor y se observa que la masa 1 aumenta su temperatura un grado centígrado, mientras que la masa 2 la aumenta 3 grados centígrados. ¿Cuál es la relación entre ambas masas?
¿Cuál será la proporción entre las masas de hielo en escamas y agua de mar para obtener una mezcla final de agua-hielo a ![]() , sabiendo que las temperaturas iniciales del hielo y el agua son
, sabiendo que las temperaturas iniciales del hielo y el agua son ![]() y
y ![]() ?
?
Datos: ![]() ;
; ![]() ;
; ![]() .
.
En un vaso de cobre, cuya masa es de 1.5 kg, que contiene un bloque de hielo de 10 kg a la temperatura de ![]() , se inyectan 5 kg de vapor de agua a
, se inyectan 5 kg de vapor de agua a ![]() . Determina el estado de la mezcla.
. Determina el estado de la mezcla.
Datos: ![]() ;
; ![]() ;
; ![]() ;
; ![]()
Se calienta una barra de hierro de 210 g y luego se coloca en 100 g de agua en un recipiente aislado. La temperatura del agua aumenta desde los ![]() hasta los
hasta los ![]() . ¿Cuál fue la temperatura inicial de la barra de hierro?
. ¿Cuál fue la temperatura inicial de la barra de hierro?
Los calores específicos son: ![]() ;
; ![]()
Un trozo de plomo, de masa 200 g, se calienta a ![]() y se echa a 500 g de agua que están a
y se echa a 500 g de agua que están a ![]() . Determina la temperatura final del plomo y del agua.
. Determina la temperatura final del plomo y del agua.
Datos: ![]() ;
; ![]()
Un recipiente de cobre, que tiene una masa de 500 g, contiene 150 g de agua a ![]() . Se sumerge en el agua una esfera de plata de 250 g a
. Se sumerge en el agua una esfera de plata de 250 g a ![]() . Calcula la temperatura del equilibrio térmico.
. Calcula la temperatura del equilibrio térmico.
Calores específicos ![]() :
: ![]() ;
; ![]() ;
; ![]() .
.
 Ejercicios FyQ
Ejercicios FyQ