Si se sabe que una reacción es endotérmica en una dirección, ¿qué puede decirse de la reacción en sentido opuesto?
Ejercicios y problemas de Termoquímica para 2.º de Bachillerato.
Si se sabe que una reacción es endotérmica en una dirección, ¿qué puede decirse de la reacción en sentido opuesto?
Para la obtención del tetracloruro de carbono según: ![]() :
:
a) Calcula el calor de reacción, a presión constante, a 25 ºC y en condiciones estándar.
b) ¿Cuál es la energía intercambiada en la reacción anterior, en las mismas condiciones, cuando se forma un litro de tetracloruro de carbono cuya densidad es 1,4 g/mL?
Datos: ![]() ;
; ![]() ;
; ![]() ; Masas atómicas: C = 12 ; Cl = 35,5
; Masas atómicas: C = 12 ; Cl = 35,5
Para la reacción de formación de agua, a 298 K y 1 atm, según la ecuación:
![]()
Los valores de entalpía y entropía estándar son: ![]() y
y ![]()
Calcula:
a) El valor de la variación de energía libre en estas condiciones.
b) La temperatura a la que el sistema no evoluciona por encontrarse en equilibrio, suponiendo que la entalpía y la entropía no varían con la temperatura.
La concentración de ![]() en la atmósfera está aumentando de forma constante debido al uso de combustibles fósiles cómo fuente de energía y es teóricamente posible demostrar que este hecho es el causante de producir un incremento de la temperatura de la Tierra (efecto invernadero).
en la atmósfera está aumentando de forma constante debido al uso de combustibles fósiles cómo fuente de energía y es teóricamente posible demostrar que este hecho es el causante de producir un incremento de la temperatura de la Tierra (efecto invernadero).
Escribe las reacciones balanceadas de combustión de los siguientes combustibles:
a) Hidrógeno (![]() )
)
b) Propano (![]() )
)
c) Metano (![]() )
)
Indica razonadamente cuál de ellos desprende mayor cantidad de calor por gramo quemado y cuál es el que menos contamina.
Dada la siguiente ecuación termoquímica:
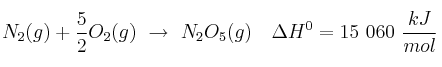
Calcula el calor (en kJ) que es absorbido durante la formación de 25,0 g de ![]() .
.