a) Calcula la variación de entalpía estándar correspondiente a la reacción:
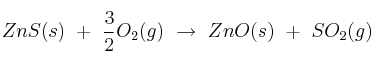
b) ¿Qué calor se absorbe o desprende , presión constante, cuando reaccionan 100 g de ZnS(s) con oxígeno en exceso?
Datos: ![]() ;
; ![]() ;
; ![]() . Masas atómicas: S = 32 ; O = 16 ; Zn = 65,4.
. Masas atómicas: S = 32 ; O = 16 ; Zn = 65,4.
 EjerciciosFyQ
EjerciciosFyQ
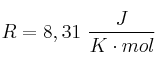 ;
;