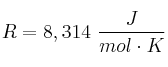La reacción utilizada para la soldadura aluminotérmica es:
![]()
a) Calcula el calor a presión constante y el calor a volumen constante intercambiados en condiciones estándar y a la temperatura de la reacción.
b) ¿Cuántos gramos de ![]() se habrán obtenido cuando se desprendan 10 000 kJ en la reacción?
se habrán obtenido cuando se desprendan 10 000 kJ en la reacción?
Datos: ![]() ;
; ![]() . Masas atómicas: Al = 27 ; O = 16.
. Masas atómicas: Al = 27 ; O = 16.
 EjerciciosFyQ
EjerciciosFyQ