-
PAU Andalucía: química (junio 2025) - pregunta 3 - cuestión 3B (8485)
Se preparan 250 mL de una disolución acuosa de 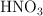 a partir de 2 mL de una disolución comercial de densidad
a partir de 2 mL de una disolución comercial de densidad 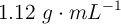 y
y 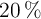 de riqueza en masa.
de riqueza en masa.
a) ¿Qué molaridad y pH tendrá la disolución preparada?
b) ¿Qué volumen de una disolución de NaOH 0.02 M será necesario añadir para neutralizar 100 mL de la disolución que se ha preparado?
Masas atómicas relativas: O= 16; N= 14; H= 1
-
EBAU Andalucía: química (junio 2024) - ejercicio C.3 (8275)
Se preparan 10 L de una disolución de ácido metanoico (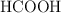 ) disolviendo 23 g en agua. Teniendo en cuenta que el pH de la disolución es 3, calcula:
) disolviendo 23 g en agua. Teniendo en cuenta que el pH de la disolución es 3, calcula:
a) El grado de disociación del ácido.
b) El valor de la constante de disociación.
Masas atómicas relativas: C= 12 ; O= 16 ; H= 1
-
EBAU Andalucía: química (junio 2024) - ejercicio B.5 (8266)
Justifica si las siguientes afirmaciones son verdaderas o falsas:
a) En una disolución diluida de un ácido fuerte HX hay mayor proporción de HX que de 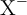 .
.
b) Cuando se disuelve 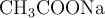 en agua se producen iones
en agua se producen iones 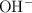 .
.
c) El pH de una disolución 0.1 M de HCl es menor que el de una disolución 0.1 M de 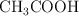 (
(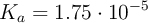 ).
).
-
EBAU Andalucía: química (junio 2024) RESERVA - ejercicio C.3 (8244)
Se disuelven 0.2 g de 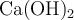 en agua, hasta un volumen final de 250 mL. Basándote en la reacción de disociación correspondiente, calcula:
en agua, hasta un volumen final de 250 mL. Basándote en la reacción de disociación correspondiente, calcula:
a) La molaridad de la disolución y su pH.
b) El pH de una disolución obtenida al diluir 15 mL de la disolución del enunciado en agua hasta un volumen de 100 mL.
Datos: Ca = 40 ; O = 16 ; H = 1.
-
EBAU Andalucía: química (junio 2024) RESERVA - ejercicio B.5 (8240)
Justifica, escribiendo las correspondientes reacciones, si el pH de las siguientes disoluciones acuosas es ácido, básico o neutro:
a) Disolución de 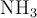 cuya constante de equilibrio es
cuya constante de equilibrio es 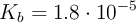 .
.
b) Disolución de NaBrO, teniendo en cuenta que la constante de equilibrio del 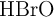 es
es 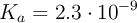 .
.
c) Disolución resultante de la mezcla de 100 mL de HCl 0.2 M y de 150 mL de NaOH 0.2 M.