En el contexto de la economía circular y la sostenibilidad, una empresa de reciclaje está desarrollando un proceso para recuperar cobre y cinc de baterías alcalinas agotadas, aprovechando estos metales para construir una pila de aluminio-aire como alternativa ecológica a las baterías tradicionales.
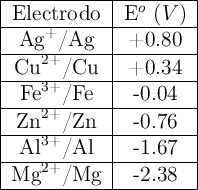
Los siguientes potenciales estándar de reducción a considerar son:
| Par redox | $$$E^\circ\ (\text{V})$$$ |
| $$$\text{Al}^{3+}/\text{Al}$$$ | −1.66 |
| $$$\text{Zn}^{2+}/\text{Zn}$$$ | −0.76 |
| $$$\text{Fe}^{2+}/\text{Fe}$$$ | −0.44 |
| $$$\text{Cu}^{2+}/\text{Cu}$$$ | +0.34 |
| $$$\text{O}_2/\text{OH}^- , (\text{en medio básico})$$$ | +0.40 |
Apartado a)
En el proceso de recuperación, se tiene una disolución que contiene iones $$$\text{Cu}^{2+}$$$ 1 M e iones $$$\text{Fe}^{2+}$$$ 1 M. Se dispone de láminas de cinc y aluminio para seleccionar el metal reductor más adecuado.
a.1) Justifica qué metal (cinc o aluminio) es más adecuado utilizar para recuperar cobre metálico por reducción selectiva, sin que se reduzca el hierro presente en la disolución. Escribe las semirreacciones que tendrían lugar en el ánodo y en el cátodo, y calcula la fuerza electromotriz de la pila formada.
a.2) Si en lugar de usar la disolución anterior se construye una pila de aluminio-aire donde el aluminio se oxida y el oxígeno del aire se reduce en medio básico según la semirreacción: $$$\text{O}_2 + 2\text{H}_2\text{O} + 4e^- \rightarrow 4\text{OH}^-$$$, calcula el potencial estándar de esta pila y justifica por qué es una fuente de energía prometedora para vehículos eléctricos.
Apartado b)
Se necesita determinar si una muestra de cobre metálico contiene impurezas de cinc para verificar su pureza. Se sumerge la muestra en una disolución de ácido clorhídrico 1 M.
b.1) Razona, utilizando los potenciales de reducción, si el cobre puro se disolverá en HCl. Escribe las semirreacciones ajustadas por el método del ion-electrón si la reacción es espontánea, o justifica por qué no lo es.
b.2) Si la muestra contiene impurezas de cinc, ¿qué observación experimental permitiría detectarlas? Justifica la respuesta con la correspondiente reacción química ajustada.
Apartado c)
Una vez recuperado el cobre metálico, se utiliza como cátodo en una celda electrolítica para recubrir con una capa de cobre de 0.05 mm de espesor un objeto de hierro con superficie total de 200 $$$\text{cm}^2$$$. La densidad del cobre es $$$8.96\ \text{g/cm}^3$$$.
c.1) Calcula la masa de cobre que debe depositarse sobre el objeto.
c.2) Determina el tiempo necesario para realizar este recubrimiento si se aplica una corriente constante de 3.50 A.
Datos: Masa atómica relativa: Cu = 63.5; Al = 27.0; Zn = 65.4; Fe = 55.8. Constante de Faraday: $$$\text{F} = 96\ 485\ \text{C} \cdot \text{mol}^{-1}$$$.
 EjerciciosFyQ
EjerciciosFyQ