La fermentación de glucosa, (![]() ), produce alcohol etílico, (
), produce alcohol etílico, (![]() ), y dióxido de carbono, según la reacción:
), y dióxido de carbono, según la reacción:
![]()
¿Cuántos gramos de etanol se pueden producir a partir de 10.0 g de glucosa?
Al reaccionar 10 g de carbonato de magnesio con exceso de ácido fosfórico, ¿qué cantidad de sal se produce?
¿Qué cantidad de hierro se obtiene a partir de 1 tonelada de trióxido de dihierro, cuya pureza es el ![]() , mediante un proceso de obtención con un rendimiento del
, mediante un proceso de obtención con un rendimiento del ![]() ?
?
Datos: Fe = 56 ; O = 16.
Se quieren obtener 10 L de ![]() a
a ![]() y 780 torr de presión y se dispone de hierro al
y 780 torr de presión y se dispone de hierro al ![]() de pureza y de ácido sulfúrico 1 M. ¿Cuántos gramos de ese hierro y cuántos mililitros del ácido serán necesarios?
de pureza y de ácido sulfúrico 1 M. ¿Cuántos gramos de ese hierro y cuántos mililitros del ácido serán necesarios?
Masa atómica del hierro 56.
Los tres astronautas del Apolo 13, que fueron lanzados el 11 de abril y regresaron a la tierra el 17 de abril de 1970, se mantuvieron vivos durante su misión, en parte, por los recipientes de hidróxido de litio diseñados para eliminar del aire el ![]() exhalado por los astronautas. El hidróxido de litio sólido reacciona con el
exhalado por los astronautas. El hidróxido de litio sólido reacciona con el ![]() para formar carbonato de litio sólido y agua. Suponiendo que en un astronauta exhala 1.00 kg de
para formar carbonato de litio sólido y agua. Suponiendo que en un astronauta exhala 1.00 kg de ![]() por día:
por día:
a) Plantea la ecuación quimica balanceada.
b) Determina los moles de ![]() producidos en la exhalación de un día.
producidos en la exhalación de un día.
c) ¿Qué masa, expresada en gramos, de hidróxido de litio se requiere para eliminar todo el ![]() exhalado por los tres astronautas durante toda la misión?
exhalado por los tres astronautas durante toda la misión?
Masas atómicas en ![]() : Li = 7 ; O = 16 ; H = 1 ; C = 12.
: Li = 7 ; O = 16 ; H = 1 ; C = 12.
Una masa de magnesio reacciona con cantidad suficiente de ácido clorhídrico. ¿Cuántos gramos de magnesio, con una pureza del ![]() , se necesitan para obtener 25 L de hidrógeno medidos a 667 mm Hg y
, se necesitan para obtener 25 L de hidrógeno medidos a 667 mm Hg y ![]() ?
?
Masa atómica del Mg = 24,3 ; 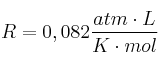
Se hacen reaccionar 10 moles de ácido nítrico con carbonato de sodio. Determina cuántos gramos de nitrato de sodio se obtienen.
Masas atómicas: Na = 23 ; O = 16 ; N = 14.
El litio y el nitrógeno reaccionan para producir nitruro de litio según a reacción:
![]()
Si se hacen reaccionar 5 g de cada reactivo y el rendimiento es del ![]() , ¿cuántos gramos de
, ¿cuántos gramos de ![]() se obtendrán en la reacción?
se obtendrán en la reacción?
Masas atómicas: Li = 7 ; N = 14.
Hacemos pasar ![]() de
de ![]() , medidos a
, medidos a ![]() y 1 atm, a través de una disolución que contiene exceso de
y 1 atm, a través de una disolución que contiene exceso de ![]() , formándose
, formándose ![]() y
y ![]() . Determina la masa de
. Determina la masa de ![]() que se formará.
que se formará.
Masas atómicas: S = 32 ; Cu = 63.5.
Cuando reacciona el magnesio (Mg = 24.3 u) con el oxígeno (O = 16 u) se produce óxido de magnesio. Escribe y ajusta la reacción y contesta:
a) ¿Qué masa y cantidad de óxido se obtiene si partimos de 200 g de magnesio?
b) ¿Qué masa y cantidad de oxígeno se consume en el caso anterior?
c) ¿Cuántas moléculas de oxígeno reaccionan cuando se obtiene un mol de óxido?
Número de Avogadro: ![]() .
.
 Ejercicios FyQ
Ejercicios FyQ