Antes de comenzar a nombrar y a formular compuestos, es necesario establecer una serie de pautas y normas que permitan sistematizar la forma de escribir su fórmulas y sus nombres. Estas normas son estrictas y requieren ser seguidas al pie de la letra para conseguir entender, y que nos entiendan, cuando nombramos o formulamos compuestos.
También es importante conocer los sistemas que vamos a usar para nombrar los compuestos. En los siguientes apartados aprenderás cuáles son esas normas y qué tipos de nomenclatura son aceptadas.
Llamamos «formular» a expresar la composición de una sustancia a partir de fórmulas, siguiendo las normas para escribirlas. Por otro lado, llamamos «nombrar» a proporcionar el nombre asociado a una fórmula dada, atendiendo también a las normas para ello. Cada nombre debe ser específico de una fórmula, aunque una misma fórmula puede tener varios nombres, dependiendo del sistema de nomenclatura que usemos.
Normas para escribir fórmulas
El orden en el que vamos a escribir los símbolos de los átomos que forman una sustancia sigue un convenio. La siguiente imagen es útil para ilustrarlo: en ella puedes ver la prioridad para colocar el elemento a la derecha de la fórmula que escribes. La posición del hidrógeno en esta imagen te debe llamar mucho la atención: ¡el hidrógeno se sitúa delante del nitrógeno!
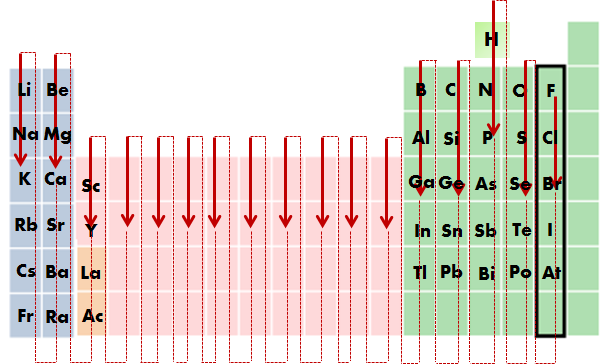
- Para hacer la fórmula de un compuesto, se escriben juntos los símbolos de los átomos: el más electronegativo a la derecha y el menos electronegativo a la izquierda. Si hay más de un átomo de un tipo, usamos un número al lado derecho del símbolo, en forma de subíndice. Por ejemplo, el AlH3 es una sustancia que contiene aluminio e hidrógeno en proporción 1:3. Observa que no es necesario poner el subíndice 1.
- Cuando un subíndice afecta a más de un átomo se utilizan paréntesis. Un ejemplo es el Ni(OH)3, sustancia que contiene níquel, oxígeno e hidrógeno y se encuentran en la proporción 1:3:3.
- En el caso de que escribamos iones, se debe escribir en primer lugar el número seguido del signo positivo «+» o negativo «-», en forma de superíndice. No se escribe el número 1, solo el signo. Puede usarse un paréntesis para indicar que la carga afecta al conjunto de átomos que encierra el paréntesis.
Vamos a escribir algunos ejemplos:
| Bien escrito | HCl | MnO2 | OBr2 | K+ | S2- | (HCO3)- | OH- |
| Mal escrito | ClH | O2Mn | Br2O | K1+ | S-2 | HCO31- | OH-1 |
En ocasiones, es necesario indicar el estado de agregación de una sustancia usando (s) para sólido, (l) para líquido, (g) para gas y (ac) para disuelto. Debe escribirse inmediatamente al lado de la fórmula sin dejar espacio. Por ejemplo, NaCl(s) está bien escrito y NaCl (s) está mal escrito.
Normas para escribir nombres
Los tres sistemas de nomenclatura que vas a aprender tienen en común que usan afijos (sufijos, infijos y prefijos) que modifican los nombres de las sustancias. El uso de estos afijos debe seguir las normas que detallamos a continuación.
Normas en el uso de prefijos multiplicadores
Se usan los prefijos numerales latinos cuando denotamos átomos, pero cuando nos referimos a grupos de átomos debemos usar los prefijos numerales griegos: bis- (2), tris- (3), tetraquis- (4), etc. Mira las tablas de ambos prefijos numerales:
| Prefijos numerales latinos | |||||
| mono- | 1 | penta- | 5 | nona- | 9 |
| di- | 2 | hexa- | 6 | deca- | 10 |
| tri- | 3 | hepta- | 7 | undeca- | 11 |
| tetra- | 4 | octa- | 8 | dodeca- | 12 |
| Prefijos numerales griegos | |||
| bis- | 2 | hexaquis- | 6 |
| tris- | 3 | heptaquis- | 7 |
| tetraquis- | 4 | octaquis- | 8 |
| pentaquis- | 5 | nonaquis- | 9 |
Si tuviéramos que referirnos a los subíndices 11 y 12, los términos correctos serían «endecaquis-» y «dodecaquis-», respectivamente.
La grafía que se propone en este documento es la correcta en castellano como traducción del griego, habiendo sido revisada por la doctora en filología clásica Sara Martínez Navarro.
Vamos a ver algunos ejemplos aclaratorios:
| Ca(NO2)2 |
bis(dioxidonitrato) de calcio bis(nitrito) de calcio |
Como el primer subíndice afecta al paréntesis, debemos usar el prefijo griego. |
| Cr2(SO4)3 |
tris(tetraoxidosulfato) de dicromo tris(sulfato) de dicromo |
El prefijo latino no precisa del uso de paréntesis y por eso aparece junto al resto de elementos que hay dentro del mismo. |
| P2O3 | trióxido de difósforo | Al no haber paréntesis, solo se usan prefijos latinos. |
- El prefijo mono- es innecesario. Solo se usa para enfatizar la estequiometría cuando se comentan sustancias relacionadas. Se suele llamar monóxido de carbono al CO (cuando se compara con el CO2) pero el nombre óxido de carbono es totalmente correcto. Los prefijos multiplicadores no son necesarios en las sustancias binarias si no existe ambigüedad.
- El Ca3P2, puede llamarse fosfuro de calcio y es igual de correcto que difosfuro de tricalcio, al igual que el MgBr2 puede nombrarse como bromuro de magnesio o dibromuro de magnesio.
- Al usar prefijos para escribir nombres de sustancias no se pueden eliminar letras. Por ejemplo, pentaóxido de difósforo (P2O5) no puede escribirse pentóxido de difósforo. Solo está permitido el caso de monóxido (que también puede ser monoóxido).
Normas en el uso de números de oxidación y números de carga
- El uso del número de oxidación en el nombre de la sustancia debe hacerse en números romanos, entre paréntesis, y escrito inmediatamente al lado del nombre del elemento sin dejar espacio. El compuesto PbCl4 se nombra cloruro de plomo(IV) y no cloruro de plomo (IV).
- En el caso de compuesto iónicos, se puede usar la carga del ion para nombrar el compuesto y se escribe entre paréntesis, primero el número y luego el signo, inmediatamente al lado del nombre del elemento, sin dejar espacio. Para la sal iónica FeBr2 es correcto bromuro de hierro(2+) y estarían mal escritos bromuro de hierro (2+) o bromuro de hierro(+2). Cuidado porque para nombrar de esta manera sí que hay que escribir el número uno dentro del paréntesis: el CuCl hay que nombrarlo como cloruro de cobre(1+). Para usar este tipo de nomenclatura hay que estar seguro de que se trata de un compuesto iónico.