Las sustancias simples
Las sustancias simples son las que están formadas por un único tipo de átomo. Dentro de este tipo de sustancias puedes encontrar los metales (Fe, Cu, Pt), los gases monoatómicos (He, Ne) o las moléculas homonucleares (O2, Cl2, S6, P4, O3) sustancias formadas por un solo elemento, aunque puedan tener más de un átomo.
Metales
Los metales se nombran del mismo modo que el elemento que los compone. Serán por tanto hierro (Fe), cobre (Cu) o platino (Pt), por ejemplo.
Enlace metálico
Los átomos de los metales se caracterizan por tener pocos electrones en su última capa y no forman enlaces covalentes, ya que compartiendo electrones no adquieren la estructura de gas noble. Forman entonces un enlace metálico, con el que consiguen la estabilidad, compartiendo los electrones de valencia de manera colectiva. Es un enlace bastante fuerte.
|
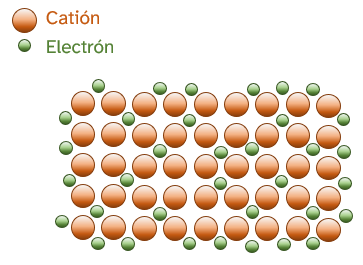
Uno de los modelos que explica este tipo de enlace es el «modelo del mar de electrones». Cada átomo de metal aporta sus electrones de valencia y se dispone, como catión, en una red cristalina que se ve envuelta por los electrones comunes. La estructura del metal podría considerarse como cationes formando los nodos de la estructura cristalina estabilizados por una nube de electrones que evita la repulsión entre los mismos. |
|
Propiedades de los metales
- Son dúctiles y maleables debido a que no existen enlaces con una dirección determinada. Si se distorsiona la estructura, los electrones vuelven a estabilizarla interponiéndose entre los cationes.
- Son buenos conductores debido a la deslocalización de los electrones.
- Conducen el calor debido a la compacidad de los átomos que hace que las vibraciones en unos se transmitan con facilidad a los de al lado.
- Tienen, en general, altos puntos de fusión y ebullición dependiendo de la estructura de la red. La mayoría son sólidos.
- Tienen un brillo característico debido a que absorben energía de casi cualquier longitud de onda, que inmediatamente emiten (reflejo y brillo).
Gases monoatómicos
Los gases monoatómicos, al igual que los metales, también se nombran del mismo modo que el elemento que los compone. Serán por tanto helio (He) o neón (Ne).
Al ser monoatómicos, no se establecen enlaces entre los átomos que los componen. Son de este tipo los gases nobles, los vapores metálicos y algún gas diatómico a muy baja presión, como le ocurre al oxígeno en la parte más alta de la atmósfera.
Moléculas homonucleares
Las moléculas homonucleares se nombran usando el prefijo numeral que corresponda: dicloro (Cl2), hexaazufre (S6), tetrafósforo (P4). Excepciones a esta regla serán el oxígeno (O2) o el ozono (O3), que la IUPAC acepta como nombres correctos dado que su extensión en otras ramas del saber es muy amplia. Ante la duda, recomiendo el uso del prefijo numeral. De ese modo, se obtiene un nombre sistemático que es aceptado por la IUPAC: dioxígeno o trioxígeno son correctos.
Enlace covalente
En las moléculas homonucleares se produce una singularidad: todos los átomos que forman la sustancia son del mismo elemento. Esto significa que todos los átomos tienen la misma electronegatividad, es decir, la misma tendencia a captar electrones. No hay un átomo más dispuesto que otro a ceder o aceptar electrones. La única manera de establecer un enlace entre ellos es, en este caso, compartiendo sus electrones. Digamos que se trata de una «solución de compromiso». Quizás lo entiendas mejor si analizamos algunas de las sustancias que hemos nombrado más arriba.
| Sustancia | Enlaces |
| O2 | 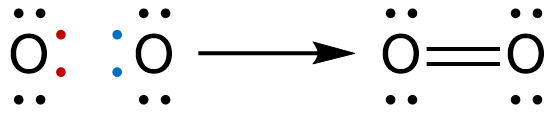 |
| Cl2 |  |
| P4 | 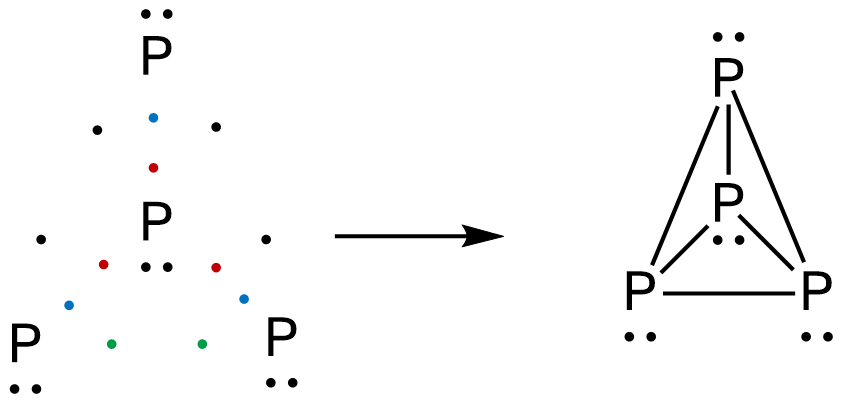 |
Como puedes ver, cada par de electrones forma un enlace y, al ser idénticos los átomos, ese par de electrones se dispondrá a la misma distancia de un núcleo que del otro, dando lugar a un enlace covalente apolar. Como puedes ver en las estructuras anteriores, todos los átomos están rodeados de cuatro pares de electrones. Se conoce como «regla del octeto» a esta condición.
En los dos siguientes vídeos puedes ver una explicación más amplia del enlace covalente y de cómo hacer las estructuras de Lewis, que es importante que aprendas a hacer y formará parte de una de las tareas de evaluación.
Propiedades de los compuestos covalentes
Lo primero que debes saber es que hay dos tipos de compuestos covalentes: los compuestos moleculares y los compuestos cristalinos. En la tabla puedes ver sus propiedades físicas y químicas, aunque debes prestar atención a lo distintas que pueden ser las unos y las de otros.
| Compuestos moleculares | Compuestos cristalinos |
|
|
Iones simples
Un ion es una partícula que posee carga eléctrica. En nuestro caso, puede ser un átomo o grupo de átomos. Si la carga es negativa decimos que se trata de un anión, mientras que si la carga es positiva hablamos de catión.
Los aniones monoatómicos se nombran empleando el sufijo -uro al final del nombre del átomo al que se le eliminan las últimas vocales. Es una excepción el oxígeno, que se nombra como óxido. La carga del anión se indica con el número de carga pero se puede omitir si el anión presenta una única carga. En la siguiente tabla se relacionan los nombres de los aniones monoatómicos:
| Fórmula | Nombre |
Fórmula |
Nombre |
| H- | hidruro(1-) o hidruro |
Te2- | telururo(3-) o telururo |
| F- | fluoruro(1-) o fluoruro | N3- | nitruro(3-) o nitruro |
| Cl- | cloruro(1-) o cloruro |
P3- | fosfuro(3-) o fosfuro |
| Br- | bromuro(1-) o bromuro |
As3- | arsenuro(3-) o arsenuro |
| I- | yoduro(1-) o yoduro |
Sb3- | antimonuro(3-) o antimonuro |
| O2- | óxido(2-) u óxido |
C4- | carburo(4-) o carburo |
| S2- | sulfuro(2-) o sulfuro |
Si4- | siliciuro(4-) o siliciuro |
| Se2- | selenuro(2-) o selenuro |
B3- | boruro(3-) o boruro |
En el caso de aniones homonucleares, se usarán prefijos numerales que hagan referencia al número de átomos que componen el anión. Hay algunos nombres comunes para estos aniones que son aceptados por la IUPAC y que debemos conocer:
| Fórmula | Nombre sistemático |
Nombre aceptado |
| O2- | dióxido(1-) | superóxido |
| O22- | dióxido(2-) | peróxido |
| I3- | triyoduro(1-) | |
| C22- | dicarburo(2-) | acetiluro |
| S22- | disulfuro(2-) | |
Los cationes monoatómicos se nombran usando el nombre del elemento y el número de carga. Para los cationes no se debe omitir el número de carga aunque sea único: Na+ [sodio(1+)] ; Ni2+ [níquel(2+)] ; Ni3+ [níquel(3+)] ; Ca2+ [calcio(2+)].
Cuando se trata de cationes homonucleares, habrá que usar el prefijo numeral que indique el número de átomos que constituye el catión y el número de carga. El catión más común de este tipo es el Hg22+ [dimercurio(2+)].
En química, cuando hablamos de cristal o de red cristalina, nos estamos refiriendo a estructuras ordenadas que siguen un patrón determinado. Ese orden, o patrón, le confiere propiedades químicas y físicas características a las sustancias.
Es una propiedad química que indica la tendencia que tiene un átomo a atraer hacia sí mismo a los electrones que forman un enlace.
En este tipo de enlace, los electrones se sitúan a la misma distancia de cada uno de los núcleos y eso implica que no hay polaridad, que no hay un átomo que tiene más tiempo los electrones sobre sí mismo.
Estos diagramas son una invención de Gilbert Newton Lewis, que fue un científico estadounidense que ideó el enlace covalente tras sus estudios sobre los niveles de energía externos de los átomos. Otro logro curioso es que acuñó el término «fotón» para el cuanto de energía electromagnética.