Denominamos sustancias binarias a aquellas que están formadas por dos tipos de átomos distintos. No quiere decir que la sustancia tenga solo dos átomos, sino que está compuesta por átomos de dos tipos distintos. Algunos ejemplos son: LiH, OF2, NaCl. Para formular este tipo de compuestos basta con escribir a la izquierda el elemento menos electronegativo y a la derecha el más electronegativo, teniendo en cuenta que la suma de los estados de oxidación ha de ser cero, si se trata de un compuesto neutro, o igual a la carga de la combinación, si se trata de un ion. Te lo explico paso a paso en este vídeo:
Nomenclatura de composición
La forma de nombrar será leyendo la fórmula de derecha a izquierda. Recuerda que hay tres modos de nomenclatura de composición: la que usa los prefijos numerales, la que usa el número de carga y la que usa el número de oxidación.
Prefijos numerales.
Empezaremos nombrando el elemento de la derecha y usaremos el sufijo «-uro» (la excepción es el oxígeno que se nombra como óxido), después debe aparecer la preposición «de» y, por último, el nombre del elemento de la izquierda. Cuando el subíndice es uno, podemos omitir el prefijo «mono».
Número de carga.
Esta forma de nombrar es válida para los compuestos iónicos y debemos estar seguros de que el compuesto tiene esa naturaleza y, por lo tanto, no es muy aconsejable. Seguimos la misma secuencia de antes pero después del nombre de cada elemento ponemos, entre paréntesis, la carga del ión. Recuerda que la carga de los aniones se puede omitir si no hay lugar a confusión pero no se puede hacer lo mismo con la carga del catión.
Número de oxidación.
Esta forma de nombrar se puede aplicar a cualquier combinación binaria y no tiene el problema que hemos visto con el número de carga. Lo que haremos es colocar al final del nombre, entre paréntesis y con números romanos, el número de oxidación del elemento escrito a la izquierda. Cuando no exista ambigüedad, debemos omitir el número de oxidación.
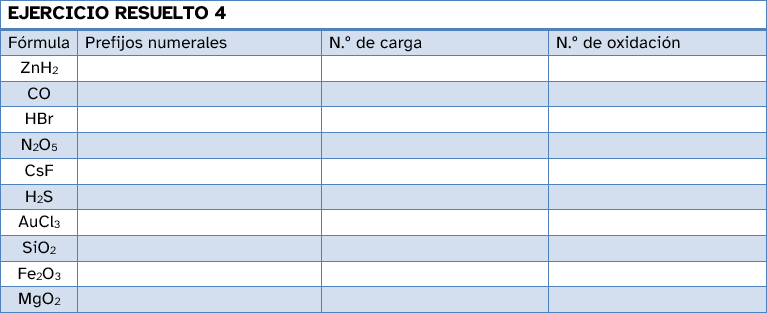
Fíjate en la siguiente tabla en la que se nombran los distintos compuestos de los tres modos, cuando es posible:
| Fórmula | Prefijos numerales | Número de carga | Número de oxidación |
| CaI2 | diyoduro de calcio | yoduro de calcio(2+) | yoduro de calcio |
| PCl5 | pentacloruro de fósforo | cloruro de fósforo(V) | |
| PdS | sulfuro de paladio | sulfuro(2-) de paladio(2+) | sulfuro de paladio(II) |
| Na2O | óxido de disodio | óxido de sodio(1+) | óxido de sodio |
Observa que no se ha nombrado el PCl5 según el número de carga porque no es un compuesto iónico. También se han omitido los números de carga de los aniones en algunos casos o los números de oxidación. Esto se puede hacer siempre que no haya posibilidad de que el elemento actúe con un número de oxidación distinto.
Las combinaciones binarias entre el oxígeno y los elementos del grupo 17, los halógenos, suponen una novedad que merece ser tratada despacio. Según el diagrama de electronegatividad que hemos utilizado, el oxígeno debe escribirse a la izquierda de la fórmula cuando se une a alguno de los halógenos. ¡Pero eso no quiere decir que su electronegatividad sea menor que la de ellos! El oxígeno es el segundo elemento más electronegativo pero aún así se debe escribir a la izquierda de la fórmula. Mira cómo quedarían algunas moléculas de este tipo:
(O2+F2-) → OF2: difluoruro de oxígeno o fluoruro de oxígeno(II)
(O2-Cl2+) → OCl2: dicloruro de oxígeno o cloruro de oxígeno(-II)
Para evitar confusiones o anomalías al usar la nomenclatura del número de oxidación, es aconsejable usar los prefijos numerales cuando vayas a nombrar combinaciones binarias de este tipo.
Enlace iónico
Este enlace se produce cuando los átomos que interactúan tienen electronegatividades distintas.
Presta atención a lo que explico en el siguiente vídeo y toma nota en tu libreta de lo que creas importante para comprender el enlace iónico
Propiedades de los compuestos iónicos
- Elevados puntos de fusión y ebullición.
- Sólidos a temperatura ambiente y presentan estructura cristalina.
- Solubles en disolvente polares como el agua, aunque hay excepciones.
- Son duros, pero frágiles.
- No conducen la electricidad, excepto si están disueltos o fundidos.
Nomenclatura de adición
Esta forma de nombrar se parece mucho a la de composición, pero recuerda que no se emplean los números de oxidación. En las combinaciones binarias, no se diferencia de la nomenclatura de composición que hemos visto, ya que sería como usar solo los prefijos numerales, así que no abundaremos más en este tipo de nomenclatura en este apartado.
Nomenclatura de sustitución
En algunos compuestos binarios sí que existen diferencias importantes entre esta forma de nombrar y la nomenclatura de composición. En el epígrafe 1.2 vimos cómo era la nomenclatura de sustitución y en la siguiente tabla se ilustran algunos ejemplos más:
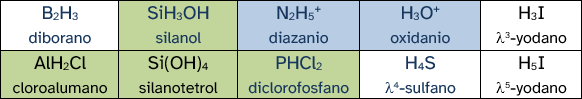
Los compuestos marcados en verde no son binarios pero sirven como ejemplo para entender cómo se usa la nomenclatura de sustitución. Los que están marcados en azul son iones (cationes) y también se pueden nombrar como derivados de los «hidruros progenitores».