Desde el origen del concepto hasta los primeros modelos atómicos
Vamos a empezar con un breve repaso por los modelos atómicos anteriores al modelo mecánico-cuántico. Los has visto en cursos anteriores y debes reconocer y recordar cada uno de los modelos. Si sientes que no es así, sería buena idea que dedicases tiempo al repaso de lo que no recuerdas. Una situación de aprendizaje sobre ello es «Los ladrillos del universo».
El origen de la palabra «átomo»
La primera referencia escrita encontrada a la palabra «átomo», para referirse a cómo era la materia, es de Demócrito de Abdera y de Leucipo de Mileto (460 - 370 aC). Fueron filósofos de la Grecia clásica que creían que se podía llegar al conocimiento pleno de los hechos simplemente pensando, sin necesidad de experimentar. El razonamiento que describen es el siguiente: si tomas una muestra de un sistema material y lo divides en partes más pequeñas cada vez, llegará un momento en el que las partes que obtienes serán tan pequeñas que no se podrán volver a dividir, es decir, habrás llegado a una porción de esa materia que es «indivisible».
El modelo de Dalton
A partir de sus estudios con ciertas sustancias gaseosas, fue capaz de elaborar el primer modelo atómico basado en datos empíricos. Los postulados en los que se basa su modelo son:
- Los elementos están formados por átomos, que son partículas esféricas diminutas, indivisibles e indestructibles.
- Todos los átomos de un mismo elemento son idénticos.
- Los átomos de distintos elementos son distintos entre sí y se caracterizan por sus pesos atómicos equivalentes (que son similares a sus masas atómicas).
- Los átomos de distintos elementos se pueden combinar entre sí para dar lugar a compuestos, pero lo hacen siempre en la misma proporción para un mismo compuesto.
- Los procesos químicos son recombinaciones de los átomos que forman las sustancias de partida para dar lugar a las sustancias finales.
Como puedes ver, las distintas sustancias compuestas se formaban por combinación de las sustancias simples y siempre siguiendo una proporción fija para una misma sustancia. Estas sustancias compuestas son lo que después llamaríamos moléculas.
Algo es empírico cuando está basado en la experiencia y es deducido a partir de datos experimentales.
El modelo de Thomson

|
Joseph J. Thomson (1856-1940) fue un magnífico físico que, usando el tubo de Crookes, realizó tres experimentos que le condujeron a descubrir una partícula atómica que acaba con el concepto de «indivisibilidad» del átomo que había estado en vigor más de dos milenios. 
|
En el tercero de los experimentos que realizó (1897), Thomson calculó la relación entre la carga y la masa de las partículas que formaban los rayos catódicos y obtuvo un valor que era más de mil veces mayor que la relación entre la carga y masa del ion hidrógeno. Este resultado lo enfrentaba ante una disyuntiva: o esas partículas tenían una carga inmensa o su masa era realmente pequeña.
La forma de llegar a esa conclusión fue la de curvar el chorro de partículas, que se aprecia como un rayo, usando una diferencia de potencial a lo largo del tubo, y luego compensar esa curvatura con un campo magnético. El esquema del experimento lo puedes ver aquí:
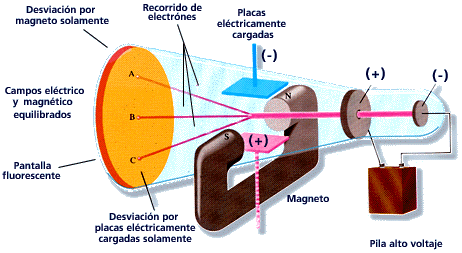
Tras el experimento, Thomson obtuvo que la relación entre la carga y la masa era:
\[\frac{q}{m} = 1.76\cdot 10^{11}\ \frac{C}{kg}\]
En aquel momento, Thomson sabía la relación carga/masa del ion hidrógeno, que se había determinado por electrolisis, y dedujo que la masa de esos corpúsculos era del orden de 1800 veces menor que la del ion hidrógeno. Fueron tres las propiedades que describió para esas partículas:
- Muchos cátodos distintos emitían el mismo tipo de partículas.
- Eran de masa mucho menor que la masa del átomo de hidrógeno, que era el de menor masa atómica.
- Tenían la misma carga que la carga del ion hidrógeno.
Con todas estas conclusiones, Thomson propuso su modelo atómico en 1904. Hay que decir que su modelo tuvo una gran aceptación porque era muy fácil de entender y explicaba algunos fenómenos que se habían observado experimentalmente, de manera solvente.
En este modelo, el átomo sería una masa de carga positiva en la que se incrustan los electrones, que tienen carga negativa. El número de electrones sería el necesario para compensar la carga positiva del propio átomo. Cuando mayor masa atómica, más grande sería él átomo y más electrones serían necesarios para compensar la carga positiva.
Modelo de Rutherford
|
Ernest Rutherford (1871 - 1937) fue discípulo de Joseph John Thomson y estuvo investigando bajo su dirección, entre 1895 y 1898, los efectos de los rayos X sobre los gases, encontrando que eran capaces de ionizar el aire, así como el gas que estuvieran estudiando en ese momento. Desde 1898 hasta 1907 estuvo trabajando sobre radiactividad en Montreal y fue capaz, junto a su discípulo Frederick Soddy, de identificar las tres radiaciones radiactivas: alfa, beta y gamma. Estos estudios le valieron la «medalla Rumford» en 1904. En 1908 descubre lo que sospechaba: que las partículas alfa son núcleos de átomos de helio, lo que le vale el premio Nobel de química ese mismo año. En 1911 es cuando, tras una serie de experimentos que duran varios años, explica su modelo de átomo y da paso a la era nuclear. |

|
En estos dos vídeos puedes ver la predicción, el resultado del experimento y cómo el modelo de Rutherford explica este resultado. Recuerda que lo realmente meritorio es hacer lo que hizo él, es decir, a partir de los resultados imaginar un modelo que los pudiera explicar.