La energía está cuantizada
Aunque el modelo atómico de Ernest Rutherford, que situaba a los protones en el núcleo del átomo y a los electrones girando alrededor de este, era muy aceptado y explicaba fenómenos observados con gran solvencia, había otro tipo de observaciones a las que no daba respuesta y que lo hicieron entrar en crisis. Algunos de los hechos observados que no podían ser explicados eran:
- Los espectros atómicos. Que fueran específicos para cada elemento no parecía que estuviese asociado a la concepción «planetaria» del modelo de Rutherford.
- Que las cargas positivas pudiesen estar juntas en un espacio tan pequeño como el núcleo atómico. Era sabido que las cargas del mismo signo se repelen y el modelo no era capaz de dar una respuesta clara a esta objeción.
- Que los electrones que giraban no cayesen sobre el núcleo. Las leyes de Maxwell establecían que, cuando las cargas eléctricas se mueven, emiten energía. Eso quiere decir que, en el modelo de Rutherford, los electrones debían ir acercándose al núcleo en sus órbitas hasta caer sobre él, llegando a colapsar el átomo.
Solución al problema del cuerpo negro
|
El padre de la teoría cuántica fue Max Planck (1858 - 1947). Entender lo que este genio fue capaz de hacer es bastante complicado, pero puedes hacerte una idea si piensas en lo siguiente: Se sabía que había dos leyes para explicar cómo emite energía un cuerpo que está a alta temperatura. El caso más claro de cuerpo de ese tipo es el Sol. Los modelos que existían eran: la ley Rayleigh-Jeans y la ley de Wien. ¿En qué se diferenciaban ambas? La primera ley funcionaba muy bien para la radiación de baja frecuencia, pero cuando se acercaba a la frecuencia de la zona ultravioleta del espectro ocurrían errores muy significativos. Ahí entraba la ley de Wien, que se ajustaba bien para las frecuencias altas. Planck se había especializado en termodinámica antes de dedicarse a la física teórica, por lo que la «catástrofe ultravioleta» que ocurría en la ley Rayleigh-Jeans debía tener una explicación que no fuese que la termodinámica fallase en ese punto. Por eso trató de crear una nueva teoría, de carácter universal, que no necesitara de la termodinámica para explicar el fenómeno de la emisión de radiación de cuerpos de alta energía (radiación del cuerpo negro). Lo que hizo fue crear una nueva ley, la ley de Planck, que explicaba perfectamente el espectro de emisión del cuerpo negro, solventando así el problema de las dos leyes anteriores. No es fácil comprender cómo lo hizo... Aquí tienes la prueba: 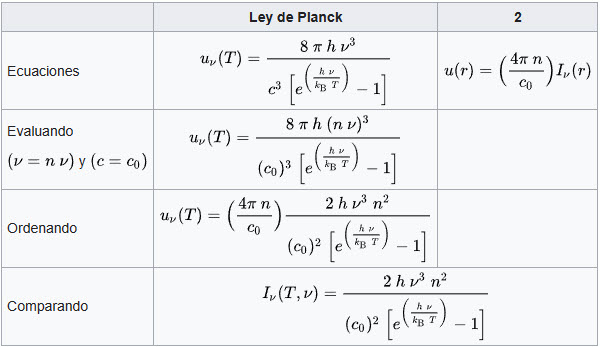
|
El 14 de diciembre de 1900 expuso uno de los descubrimientos más importantes de la historia: el valor de la constante física que lleva su nombre y la ecuación para calcular la energía de un fotón. En los cálculos anteriores aparece una «h» que es su constante. Gracias a esa constante fue capaz de deducir la ecuación que nos permite calcular la energía de un fotón. Puede parecer algo de poca importancia, pero nada más lejos de la realidad.
\[\color[RGB]{2,112,20}{\bf{E = h\cdot \nu}}\]
La energía no puede tomar cualquier valor, sino que debe ser múltiplo de esa unidad mínima de energía que indica la ecuación. Esto quiere decir que la energía no es continua, sino que es discreta. Al paquete de energía más pequeño que corresponde a una frecuencia, es decir, la energía de un fotón, se le denomina cuanto de energía.
Fue galardonado con el premio Nobel de física en 1918 «por las aportaciones que realizó en favor al avance de la física, debido a sus descubrimientos sobre los cuantos de energía».
En esta página web de la BBC puedes leer detalles sobre la vida de este magnífico genio de la física. Comprenderás que los científicos son tan humanos como el resto de los mortales.
Ampliación para mentes inquietas
La constante de Planck ha tenido otras consecuencias a posteriori. Una de ellas es la idea de que nuestro universo pueda estar formado por múltiplos de una distancia mínima que se conoce como «longitud de Planck» u «hodón». En el contexto de la física clásica, el universo es continuo.
Si se combinan las tres constantes que la física considera universales, obtenemos un valor increíblemente pequeño. La idea es calcular la distancia que recorre un fotón en el vacío. Atendiendo al análisis dimensional de esas constantes:
\[\hbar = [M][L][T]^{-2}\ ;\ G = [M]^{-1}[L]^3[T]^{-2}\ ;\ c = [L][T]^{-1}\]
Si combinamos estas tres constantes para que resulte una dimensión de longitud, obtenemos la ecuación:
\[\color{darkblue}{lP = \sqrt{\frac{\hbar\cdot G}{c^3}}}\]
El valor que obtenemos es:
\[\color{darkred}{lP = 1.616199\cdot 10^{-35}\ m}\]
Para que te hagas una idea, el radio de un electrón sería del orden 10-22 m, es decir, la distancia obtenida es muchísimo menor que los electrones y los quarks.
Esta locura también alcanza al tiempo
¿Y si calculamos el tiempo que tardaría un fotón en recorrer esa distancia en el vacío?
\[c = \frac{lP}{tP}\ \to\ tP = \frac{lP}{c} = \frac{1.616\cdot 10^{-35}\ \cancel{m}}{3\cdot 10^8\ \cancel{m}\cdot s^{-1}} = \color{darkred}{5.387\cdot 10^{-44}\ s}\]
Ese sería el tiempo de Planck, es decir, el valor de tiempo para el que todo lo que conocemos de física clásica deja de funcionar y parece que solo funcionaría la física cuántica.
Si lo necesitas, descarga el archivo EDICO con la explicación de estas curiosidades.
Un fotón es una partícula de luz portadora de interacción electromagnética. Está caracterizado por su energía, que depende de su frecuencia o su longitud de onda.
\[\color{darkred}{h = 6.63\cdot 10^{-34}\ J\cdot s}\]
Hipótesis de Planck
El estudio de la líneas espectrales que Rydberg describió en su ley permitió relacionar las líneas (de emisión o absorción) caracterizadas por su longitud de onda, en forma de número de onda, con saltos electrónicos que estaban asociados a cambios energéticos. Planck supuso que la energía que un único electrón absorbe o emite cuando se mueve en el interior del átomo estaba relacionada con el «cuanto» de energía. La radiación medida sería, por lo tanto, un múltiplo de ese valor mínimo y estaría relacionada con la cantidad de átomos que estarían emitiendo a la vez. Si emitían un total de «N» átomos en la muestra analizada, la energía medida seguiría la expresión:
\[\color[RGB]{0,112,192}{\bf{E = N\cdot h\cdot \nu}}\]
Ese número «N» tiene que ser necesariamente muy grande porque el valor de la constante «h» es muy pequeño, como has podido ver. Esto provoca que la energía que emite o absorbe la muestra nos parece que puede alcanzar cualquier valor, es decir, que es continua, como ocurre con la masa. De ahí que la osadía de Planck al plantear una hipótesis tan imaginativa tenga un enorme valor científico.
En el siguiente vídeo puedes ver cómo explico la hipótesis de Planck por si algo no te ha quedado claro: