Radiación electromagnética
Ondas electromagnéticas
Para entender los fenómenos que vas a estudiar es necesario hacer un repaso sobre la radiación electromagnética. Esta radiación se propaga en forma de ondas:
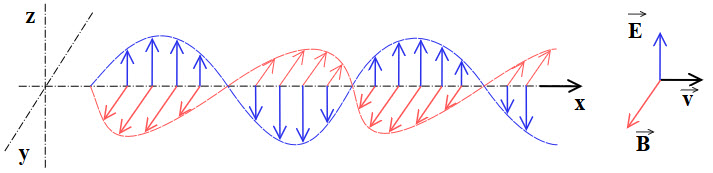
Recuerda que una onda electromagnética es aquella que se puede propagar en el vacío, en ausencia de medio material alguno, y cuya dirección de propagación es perpendicular a la oscilación de los campos magnético y eléctrico. A este tipo de ondas se les llama también ondas transversales.
Ondas en las que la vibración es perpendicular a la velocidad de propagación.
La radiación electromagnética se caracteriza, como todas las ondas, por su frecuencia o por su longitud de onda. Ambas magnitudes están relacionadas con la velocidad de propagación por la expresión:
\[\color[RGB]{2,112,20}{\bf{v = \lambda\cdot \nu}}\]
En el caso de que la radiación viaje en el vacío, la velocidad de propagación sería la velocidad de la luz «c».
Explicación en vídeo
A continuación, puedes ver un vídeo en el que explico qué es la radiación electromagnética, cuáles son las magnitudes que usamos para caracterizarla y cómo interpretar el espectro electromagnético. Quizás te pueda servir para refrescar o comprender esta primera parte del tema.
Ejercicios para practicar
Te presento dos ejercicios resueltos en los que se relacionan la frecuencia y la longitud de onda de una radiación. Te pueden servir de ayuda para terminar de entender cómo trabajar esta parte.
Primer ejercicio:
¿Cuál es la longitud de onda (en nanómetros) de la luz con una frecuencia de 8.6·1013 Hz?
Resolución del primer ejercicio.
Segundo ejercicio:
¿Cuál es la frecuencia en (Hz) de la luz con una longitud de onda de 566 nm?
Si lo necesitas, descarga en este enlace el archivo EDICO con los ejercicios y las resoluciones.
La longitud de onda y la frecuencia siguen la siguiente relación: \[\color[RGB]{2,112,20}{\bf{c = \lambda\cdot \nu}}\] Despejas: \[\color[RGB]{2,112,20}{\bf{\lambda = \frac{c}{\nu}}}\] Sustituyes y calculas: \[\lambda = \frac{3\cdot 10^8\ \cancel{m}\cdot \cancel{s^{-1}}}{8.6\cdot 10^{13}\ \cancel{s^{-1}}}\cdot \frac{10^9\ nm}{1\ \cancel{m}} = \color[RGB]{192,0,0}{\boxed{\bf{3.5\cdot 10^3\ nm}}}\]
La longitud de onda y la frecuencia siguen la siguiente relación: \[\color[RGB]{2,112,20}{\bf{c = \lambda\cdot \nu}}\] Despejas: \[\color[RGB]{2,112,20}{\bf{\nu = \frac{c}{\lambda}}}\] Sustituyes y calculas: \[\nu = \frac{3\cdot 10^8\ \cancel{m}\cdot s^{-1}}{566\cdot 10^{-9}\ \cancel{m}} = \color[RGB]{192,0,0}{\boxed{\bf{3\cdot 10^{17}\ s^{-1}}}}\]
Espectro electromagnético
El espectro electromagnético que nos llega del Sol abarca un rango de frecuencias y longitudes de onda que permite clasificar a esta radiación por intervalos y por los efectos que provocan sobre la materia y sobre los seres vivos. Aquí puedes ver ilustrado este espectro y los usos que damos a los distintos rangos de frecuencia:
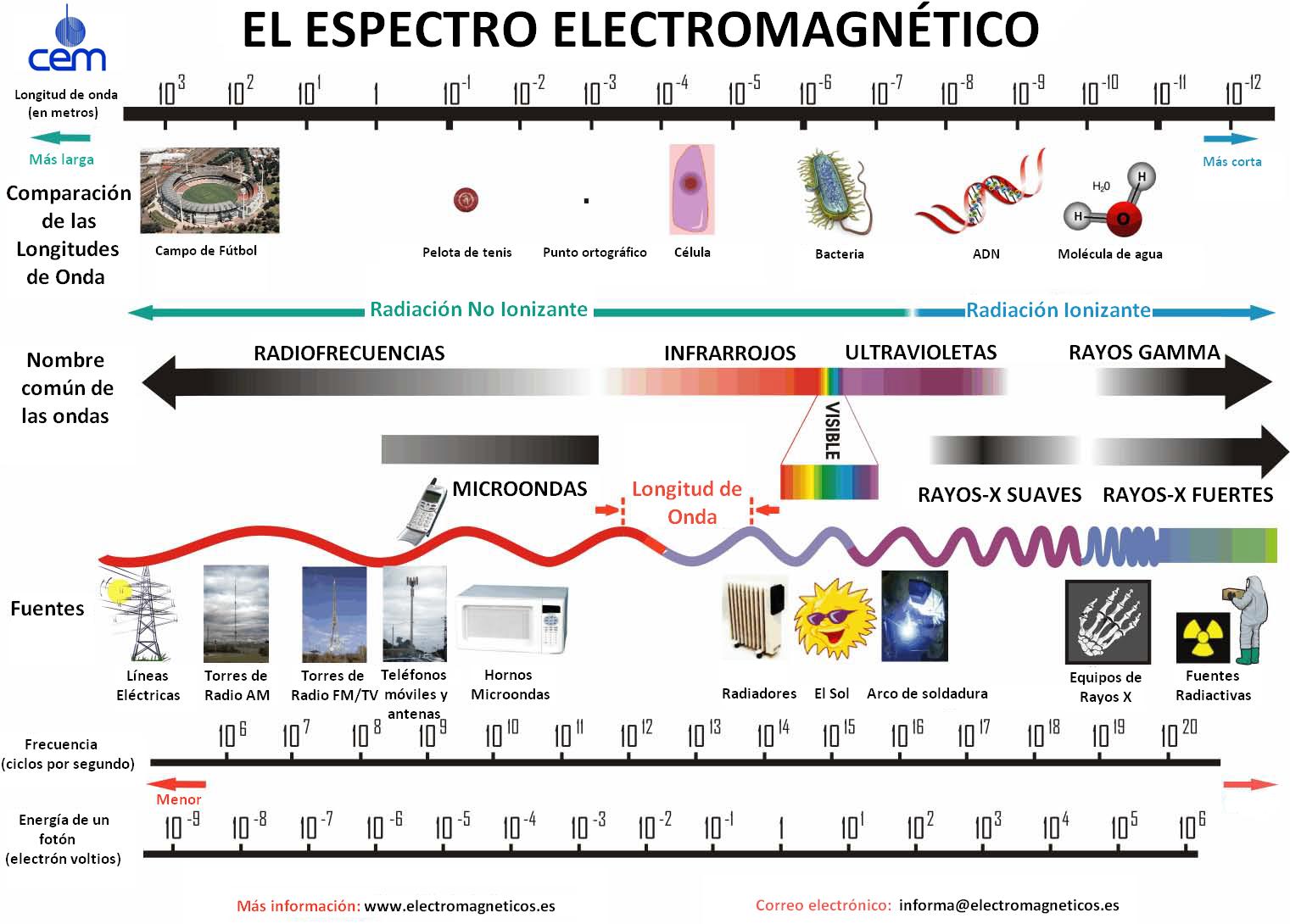
Como puedes ver, cuanto mayor es la frecuencia de la radiación (o menor su longitud de onda), mayor es su energía.

.jpg)