¿Cómo se distribuyen los electrones en el átomo?
Lo siguiente que tienes que aprender es cómo se colocan los electrones dentro de los átomos. No parece lógico que su distribución sea al azar después de todo lo que has visto.

Vas a comprobar que los electrones tienden siempre a estar lo más cerca posible del núcleo, es decir, en el estado de menor energía posible, lo que hace que podamos predecir el comportamiento de estos e incluso cómo interactuarán los átomos entre sí.
Llamamos «configuración electrónica» a la disposición de los electrones en el interior de los átomos. Los electrones no se colocan de modo aleatorio sino que siguen un orden muy concreto: se van colocando en los niveles de menor energía que estén disponibles.
Vamos a ver tres principios que son los que nos permitirán asignar de modo correcto los electrones a cada nivel.
Principio de Aufbau
Este principio fue propuesto por Niels Bohr y la idea en la que se sustenta es muy clara: los electrones tienden a estar en la capa de menor energía disponible.
La duda que surge es: ¿cómo sabemos la energía de los niveles para saber cuál tiene menor energía?
|
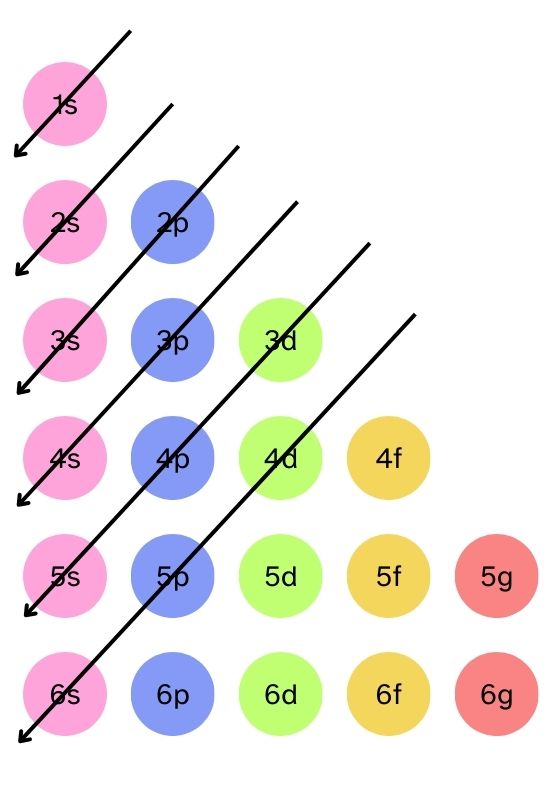
La energía de un nivel energético (u orbital) viene dada por la suma de los números cuánticos «n» y «l» de ese nivel. Se llenarán siempre primero los orbitales cuya suma «n + l» sea menor. El nivel de menor energía sería el orbital 1s, ya que estaríamos antes valores «n = 1» y «l = 0». El siguiente nivel sería el 2s, cuyos valores serían «n = 2» y «l = 0»... ¿Puede haber casos en los que la suma «n + l» dé el mismo resultado? Pues sí y tenemos que entender cómo se resuelven estos casos. Podríamos tener un orbital con «n = 4» y «l = 0» (4s) y otro con «n = 3» y «l = 1» (3p). Cuando ocurre esto, tendrá menor energía el orbital que tenga menor valor de «n», así el orbital 4s tiene mayor energía que el orbital 3p y se llenará antes este último. A la derecha tienes un diagrama que simplifica mucho la tarea de obtener la disposición correcta de los electrones. Se conoce como diagrama de Moeller y fue diseñado por Erwin Madelung. La clave está en llenar los niveles energéticos según la diagonales que ves en la imagen. Puedes ampliar el esquema lo que necesites, siguiendo la misma lógica que aprecias. |
|
Observa que, siguiendo el orden de las flechas, se llenaría antes el nivel «4s» que el nivel «3d». Es una de las excepciones que antes hemos referido, por lo que es necesario que sigas el esquema para no equivocarte al hacer la configuración electrónica de un elemento.
Principio de exclusión
Fue enunciado por Wolfgang E. Pauli en 1925 y hace referencia a los fermiones, que son un tipo básico de las partículas elementales, en los que se incluyen los electrones, que tienen espín semientero. Recuerda que los electrones tienen como espín dos valores: ±½.
Este principio impone la condición de que no puede haber dos electrones que tengan los cuatro números cuánticos iguales. Como cada orbital está definido por tres números cuánticos parece claro que tan solo podrá acoger dos electrones, de manera que uno de ellos tendrá como números cuánticos (n, l, m, +½) y para el otro será (n, l, m, -½), siendo la diferencia el valor del número cuántico «s».
Vamos a suponer que estamos en el nivel energético que está definido por los valores «n = 2» y «l = 1», es decir, el orbital 2p. Ya sabemos que los posibles valores de «m» son -1, 0 y 1. Esto quiere decir que tendríamos tres posibles orbitales cuyas ternas serían: (2, 1, -1) ; (2, 1, 0) ; (2, 1, 1). Si describimos los electrones que puede haber en dichos orbitales serían:
| (2, 1, -1) | (2, ,1, -1, +½) ; (2, ,1, -1, -½) |
| (2, 1, 0) | (2, ,1, 0, +½) ; (2, ,1, 0, -½) |
| (2, 1, 1) | (2, ,1, 1, +½) ; (2, ,1, 1, -½) |
Como puedes ver, habrá seis electrones en el nivel 2p como máximo. El llenado de los niveles se hace atendiendo a los electrones que pueden ocupar cada tipo de orbital.
- Orbital s → 2 electrones
- Orbital p → 6 electrones
- Orbital d → 10 electrones
- Orbital f → 14 electrones
- Orbital g → 18 electrones
A día de hoy, no son necesarios los orbitales «5g» o «6f» porque no hay elementos que los llenen, pero sus configuraciones electrónicas deberían seguir el orden predicho.
Supón que debes colocar 20 electrones en un átomo, ¿cómo quedarían colocados?
1s22s22p63s23p64s2
Es importante que entiendas esta notación. Los orbitales están nombrados con el número y la letra, como ya sabes, y los electrones que hay en cada uno son los superíndices que hay tras cada letra.
Principio de máxima multiplicidad
El físico alemán Friedrich Hund enunció este principio en 1927 como consecuencia de su estudio de los espectros atómicos, tratando de describir las distribuciones de menor energía en el interior de los átomos.
Cuando los electrones comparten un nivel de energía degenerado, niveles del tipo «p», «d» o «f», se disponen de manera que sus espines sean paralelos, es decir, de manera que tengan la máxima multiplicidad.
Para poder entender bien este principio es bueno representar gráficamente a los electrones ocupando los orbitales. Lo haremos dibujando flechas en cajas; las flechas serán los electrones y las cajas serán los orbitales, como puedes ver en el siguiente vídeo:
.png)
