El modelo atómico actual
Has aprendido que los electrones pueden ser descritos como ondas por medio de las funciones de onda. Además, sabes que el modelo de Bohr, en el que podíamos conocer la posición y velocidad del electrón, no es correcto porque el «principio de incertidumbre» lo impide. Solo nos queda aplicar todo lo que sabemos al caso del átomo de hidrógeno.
Postulados del modelo
|
|
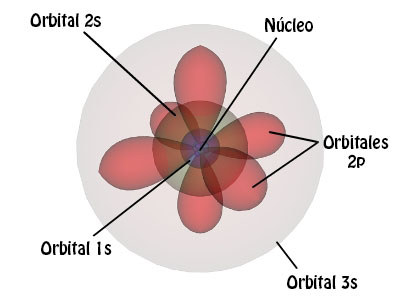
Como puedes ver en el esquema, los orbitales representados tienen formas distintas de lo que hasta ahora hemos representado. Son los números cuánticos los responsables de esas formas. Es hora de comprender qué son y qué información nos dan.
Números cuánticos
Estos números son los parámetros que permitían resolver la función de onda de Schrödinger. Es importante que entiendas cuáles son los valores que pueden tomar y cuál es el significado físico de cada uno.
- Número cuántico principal (n). Representa el nivel energético de cada orbital, es decir, está relacionado con el tamaño del átomo. Cuanto mayor es el valor de «n» más alejado está el orbital del núcleo atómico. Solo puede tomar valores de número natural (n = 1, 2, 3, ...).
- Número cuántico secundario o azimutal (l). Está relacionado con la forma del orbital porque se relaciona con su momento angular. Los valores que puede tomar están limitados por el valor que consideremos para «n». Siempre ha de ser menor que «n» y puede tomar los valores [l = 0, 1, 2, ... (n-1)].
- Número cuántico magnético (m). Nos informa sobre las orientaciones que puede adoptar el orbital atómico en el seno de un campo magnético. Los valores que puede tomar están relacionados con el valor de «l» y puede ser (m = -l, ..., 0, ..., +l). El número de posibles valores de «m» coincide con el número de posibles orientaciones del orbital.
- Número cuántico espín (s). Indica la rotación del electrón sobre sí mismo y solo puede tomar dos valores ±½. Esta animación te puede ayudar a entender el significado del espín.
Hay una idea que no puedes pasar por alto:
Los tres primeros números cuánticos se refieren a los orbitales atómicos, mientras que el cuarto número cuántico es solo para el electrón.
Si queremos definir un orbital, tendremos que usar una «terna» de números cuánticos (n, l, m), mientras que si definimos un electrón dentro de un átomo deberemos usar una «cuaterna» de números cuánticos (n, l, m, s).
¿Cómo son los orbitales?
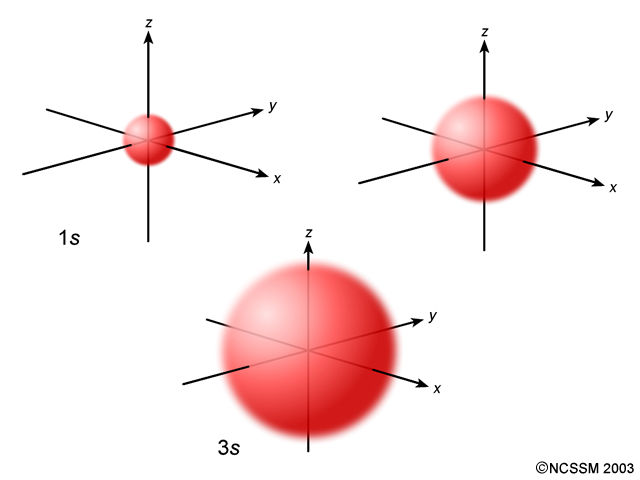
Es hora de «ver» los orbitales para entender la información que nos dan los números cuánticos. Observa que los orbitales se nombran usando una combinación de un número y una letra. El número se corresponde con el valor de «n» y la letra con el valor de «l».
|
Los tres orbitales tienen forma esférica, aunque distinto tamaño. En la forma de denotar los orbitales puedes ver que la letra es la misma en los tres casos (s), por eso tienen la misma forma, aunque sus números son distintos, por eso tienen distinto tamaño. La letra «s» está asociada al valor l = 0 y siempre implica que la forma del orbital es esférica. El único valor posible de «m» es 0, por lo que hay una única orientación, es decir, un único orbital. \[\color{green}{s\ \to\ l = 0}\] |
|
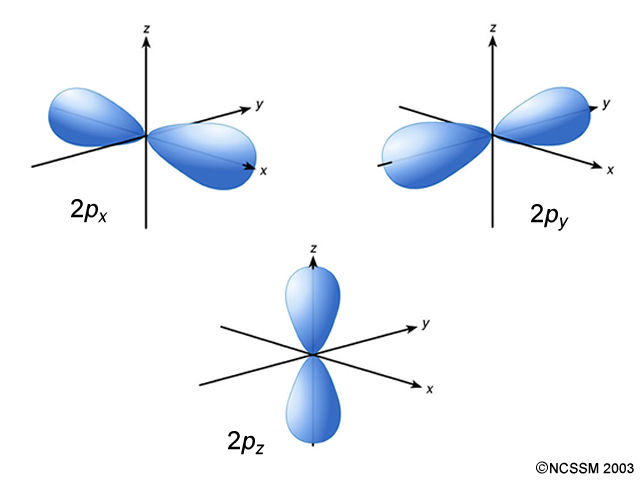
En este caso, la forma del orbital es de lóbulos según un eje longitudinal. Se trata de orbitales tipo «p». El tamaño es el mismo en los tres casos porque la imagen se centra en las orientaciones posibles que pueden tener. Al ser lineales, se pueden orientar según las tres direcciones del espacio. Aquí tienes una animación que te puede ayudar a entender mejor la orientación. La letra «p» está asociada al valor l = 1, con lo que los posibles valores de «m» son -1, 0 y 1, es decir, tres valores. Esto es lo que explica que haya tres orbitales distintos. \[\color{green}{p\ \to\ l = 1}\] |
|
|
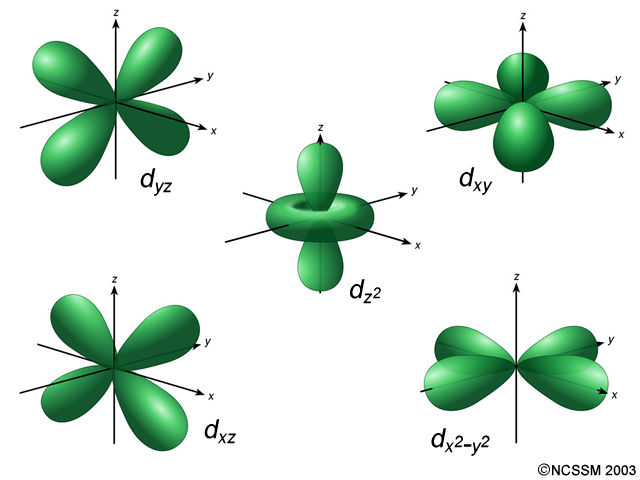
Estos orbitales son los orbitales «d» y la forma que presentan es de dos lóbulos en dos direcciones, formando un plano, excepto uno de ellos que tiene un lóbulo y un toro en el centro. Recuerda que lo que estás viendo tiene que ver con las soluciones de la ecuación de Schrödinger y no es fácil entenderlo. Hay cinco orientaciones posibles porque la letra «d» se asocia con el valor l = 2. En este caso, los valores posibles de «m» son: -2, -1, 0, 1 y 2, es decir, son cinco posibles valores y, por lo tanto, hay cinco orbitales distintos. \[\color{green}{m\ \to\ l = 2}\] |
|
Los orbitales «f» están relacionados con el valor l = 3 y presentan, por lo tanto, siete valores distintos de «m» que son: -3, -2, -1, 0, 1, 2, 3, que son las siete orientaciones que ves en la imagen. La forma de estos orbitales es de dos pares de lóbulos coplanarios que se pueden disponer de seis modos distintos, más uno que está formado por un lóbulo y dos toros. \[\color{green}{f\ \to\ l = 3}\] |

|
Puedes ver una tabla periódica interactiva, que incluye los orbitales atómicos por niveles de energía, en el portal The Orbitron.
Relación entre los números cuánticos y los orbitales
Como has podido ver, los orbitales atómicos se denotan con un número y una letra. El número corresponde al valor del número cuántico principal «n» y la letra al número cuántico secundario «l». Cada valor de «l» está asociado a una letra:
| l = 0 → s |
| l = 1 → p |
| l = 2 → d |
| l = 3 → f |
| l = 4 → g |
Recuerda que cada valor de «l» tiene asociados (2l + 1) valores de «m», que son las maneras en las que se orientan los orbitales en el espacio. Mira estos ejemplos de orbitales y sus valores de «m»:
| n = 2 ; l = 0 | 2s | m = 0 |
| n = 2 ; l = 1 | 2p | m = -1, 0, 1 |
| n = 3 ; l = 2 | 3d | m = -2, -1, 0, 1, 2 |
| n = 5 ; l = 3 | 5f | m = -3, -2, -1, 0, 1, 2, 3 |
Ya solo te queda saber que en cada uno de los orbitales, que se corresponden con los valores de «m», caben un máximo de 2 electrones. Si tienes esto en cuenta, puedes deducir el número máximo de electrones que caben en cada tipo de orbital:
- Orbital «s» → 2
- Orbital «p» → 6
- Orbital «d» → 10
- Orbital «f» → 14
Es una superficie tridimensional que resulta de hacer girar una circunferencia alrededor de un eje que no la corta. Un «donut» es un toro.
