Espectros atómicos
A finales del siglo XIX se descubrió que si se excitaban muestras de elementos químicos en estado gaseoso, éstos eran capaces de interaccionar con la radiación dando lugar a emisiones que seguían una regla bien definida, las llamadas series espectrales.
Esta interacción entre la radiación y la materia puede ser de dos modos: de emisión o de absorción.
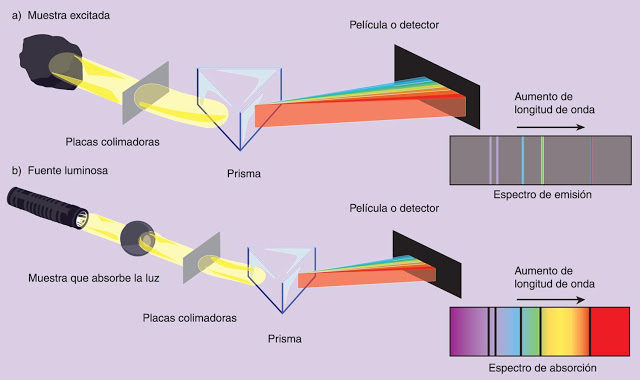
|
Espectro de emisión. Se excita la muestra proporcionándole una gran cantidad de energía y se analiza la radiación que emite la muestra cuando se relaja. |
|
Espectro de absorción. Se ilumina la muestra con luz blanca (que contiene todas las frecuencias del espectro) y se analiza la luz que atraviesa la muestra. |
Observa que ambos registros son complementarios. Si se superponen se obtiene el espectro de la luz blanca. Esto hace que los espectros atómicos sean una magnífica manera de analizar muestras en las que se busque la presencia de ciertos elementos. Una aplicación podría ser la detección de mercurio en muestras analizadas, en la industria alimentaria o en los cosméticos.
En este ENLACE puedes echar un vistazo a un trabajo de fin de grado de Ingeniería Química en el que su autora determina la presencia de metales pesados en cosméticos de venta en España, usando la espectroscopía de absorción atómica.