Fue enunciado por Wolfgang E. Pauli en 1925 y hace referencia a los fermiones, que son un tipo básico de las partículas elementales en los que se incluyen los electrones, aquellas que tienen espín semientero. Recuerda que los electrones tienen como espín dos valores: ±½.
Este principio impone la condición de que no puede haber dos electrones que tengan los cuatro números cuánticos iguales. Como cada orbital está definido por tres números cuánticos parece claro que tan solo podrá acoger dos electrones, de manera que uno de ellos tendrá como números cuánticos (n, l, m, +½) y para el otro será (n, l, m, -½), siendo la diferencia el valor del número cuántico s.
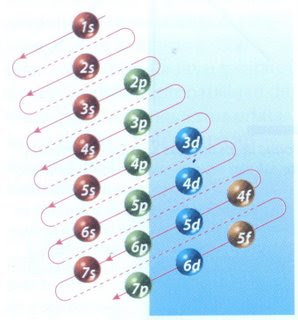
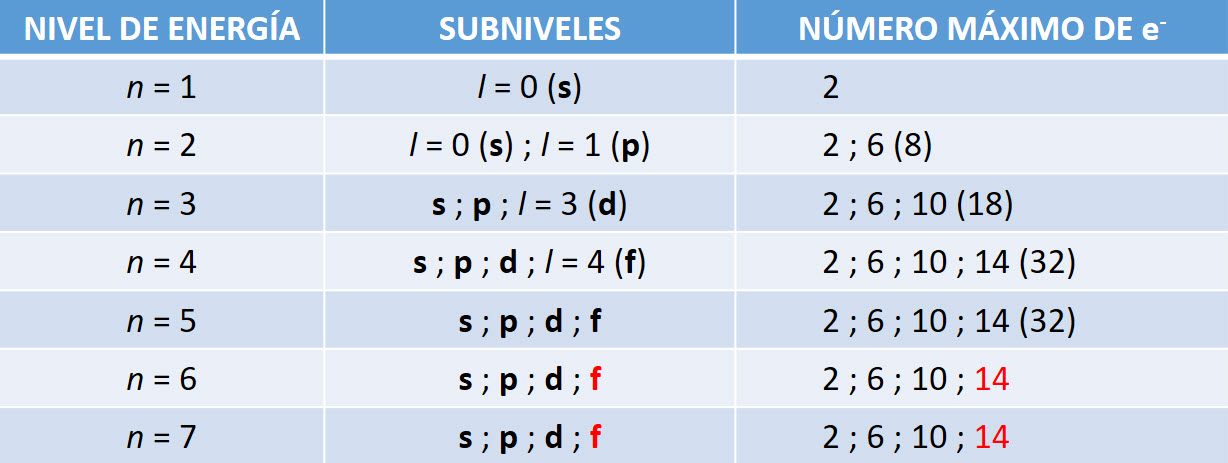
Vamos a suponer que estamos en el nivel energético que está definido por los valores n = 2 y l = 1, es decir, el orbital 2p. Ya sabemos que los posibles valores de m son -1, 0 y 1. Esto quiere decir que tendríamos tres posibles orbitales cuyas ternas serían: (2, 1, -1) ; (2, 1, 0) ; (2, 1, 1). Si describimos los electrones que puede haber en dichos orbitales serían:
| (2, 1, -1) |
(2, ,1, -1, +½) ; (2, ,1, -1, -½) |
| (2, 1, 0) |
(2, ,1, 0, +½) ; (2, ,1, 0, -½) |
| (2, 1, 1) |
(2, ,1, 1, +½) ; (2, ,1, 1, -½) |
Como puedes ver, habrá seis electrones en el nivel 2p como máximo. Puedes probar a hacer tú otros ejemplos y sacar tus conclusiones.