Como hemos dicho anteriormente, los números cuánticos eran los parámetros que proporcionaban las soluciones permitidas de las ecuaciones de Schrödinger para los distintos orbitales. Pero los valores de esos parámetros están relacionados entre sí y tienen un significado físico que es necesario conocer.
5.1. Números cuánticos
Valores y significado físico
Son cuatro los números cuánticos que definen cada electrón en el átomo:
- Número cuántico principal (n). Este número solo puede tomar valores naturales, es decir, 1, 2, 3... Representa el nivel energético de cada orbital, es decir, está relacionado con el volumen atómico si tenemos en cuenta el mayor valor de n en el átomo. Cuanto mayor sea el valor de n, más lejos estará el electrón del núcleo atómico.
- Número cuántico secundario o azimutal (l). El valor de este número está condicionado por el valor que tome n. Es un número que ha de ser SIEMPRE menor que n y que puede ser cero. Decimos que puede tomar los valores 0, 1, 2... (n - 1). Representa la forma del orbital y determina el momento angular orbital. Indica el tipo de orbital en el que se sitúa el electrón.
- Número cuántico magnético (m). Los valores de m están condicionados por el valor de l, pudiendo ser los valores que van desde -l hasta +l, pasando por el cero. Esto quiere decir que podrá tomar un valor del conjunto de valores -l..., 0, ..., +l. Este número nos informa de la orientación que adopta el orbital cuando se le aplica un campo magnético. El conjunto de posibles valores de m coincide con el número de orientaciones posibles que puede tener cada tipo de orbital en el seno de un campo magnético.
- Número cuántico espín (s). Este número solo puede tomar dos valores posibles para los electrones; el -½ y el +½. Está relacionado con la rotación del electrón sobre sí mismo, necesaria para que pueda coexistir con otro electrón en un mismo nivel energético.
Pon atención a la siguiente conclusión, porque es MUY IMPORTANTE:
Los tres primeros números cuánticos son referidos a orbitales atómicos, mientras que el cuarto número cuántico hace referencia solo al electrón.
Esto quiere decir que si nos dicen que indiquemos los números cuánticos de un niver energético o un orbital usaremos una terna de números cuánticos (n, l, m), siempre en ese orden. Si debemos referir los números cuánticos de un electrón, deberemos usar una cuaterna de números cuánticos (n, l, m, s).
Decimotercer ejercicio
Razona si son posibles los siguientes números cuánticos para definir orbitales atómicos:
a) (2, 2, 1) ; b) (3, 1, 0) ; c) (4, 0, -1) ; d) (2, 0, 0, +½).
¿Cómo son los orbitales atómicos?
Ya sabes qué significado físico tiene cada número cuántico y qué representan pero quizás sea buena idea poder ver una imagen de ellos que nos permita aclarar conceptos. Recuerda que los orbitales atómicos son zonas del espacio en las que existe la máxima probabilidad de encontrar al electrón y esas zonas, como es lógico, deben poder representarse.
El valor del número n nos da una idea del tamaño del orbital, mientras que el valor del número l nos dice la forma que tendrá el orbital. Esto puedes entenderlo mejor analizando las siguientes imágenes:
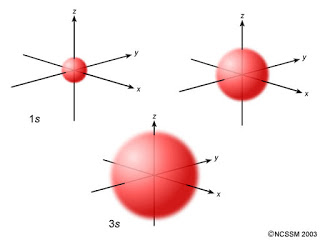
|
Los tres orbitales tienen la misma forma esférica y eso se debe a que son de tipo s, es decir, orbitales para los que l = 0. El tamaño varía según el número que precede a la letra s, ¿verdad? Eso es porque ese número hace referencia al valor del número cuántico n. Cuanto mayor es n, mayor es el orbital. Ahora ya sabes cómo se denotan los orbitales atómicos; en primer lugar ponemos el valor de n y luego asignamos una letra que se refiere al valor de l. Recuerda: si l = 0 usaremos la letra s para designar al orbital. |
|
Ahora puedes ver que ha cambiado la forma de los orbitales: este tipo de orbital corresponde al valor l = 1 y se denota con la letra p. Observa que en los tres casos el número que precede a las letras es el mismo, por eso tienen el mismo tamaño. Nos centramos ahora en otra cosa importante como es que están orientados de manera distinta. Como el orbital es lineal lo podemos orientar de tres modos distintos en el espacio. Analicemos qué valores puede tomar m cuando l = 1; el conjunto de valores sería (-1, 0, 1) (son tres valores, es decir, los tres modos que tenemos de orientar el orbital p en el espacio). Como conclusión diremos que si l = 1 vamos a usar la letra p para designarlos y el número cuántico m podrá tener tres valores, que corresponden a las tres orientaciones posibles en el espacio. |
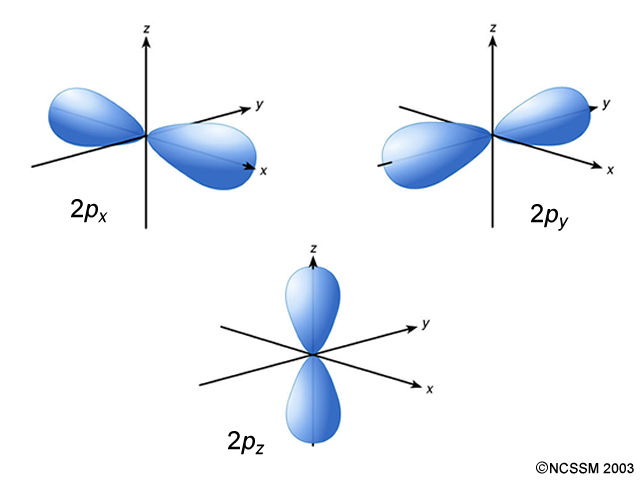
|
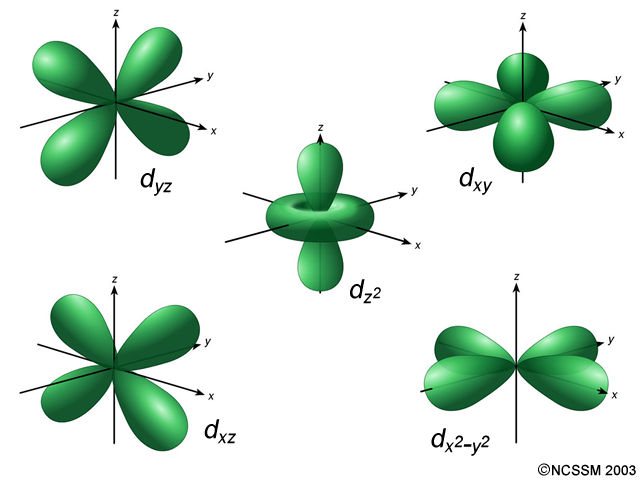
|
En este caso los orbitales parecen combinaciones de los anteriores. Se trata de orbitales d que corresponden al valor l = 2. Como puedes deducir, aparecen cinco orbitales distintos ya que el conjunto de valores de m posibles es (-2, -1, 0, 1, 2), es decir, cinco orientaciones posibles. Recuerda que se trata de las soluciones de la función de ondas y que no es simple entender la forma de estos orbitales. Si l = 2 vamos a usar la letra d para designar a los orbitales y el número cuántico m podrá adquirir cualquiera de los cinco valores posibles que se corresponden con las orientaciones en el espacio. |
|
En este caso tenemos orbitales del tipo f, que se corresponden con el valor l = 3 y que pueden presentar siete orientaciones distintas dado que m puede tomar cualquier valor del conjunto (-3, -2, -1, 0, 1, 2, 3). Usaremos la letra f para designar a los orbitales cuyo l = 3. Este tipo de orbitales son siete porque es el conjunto de valores que puede tomar el número cuántico m. |
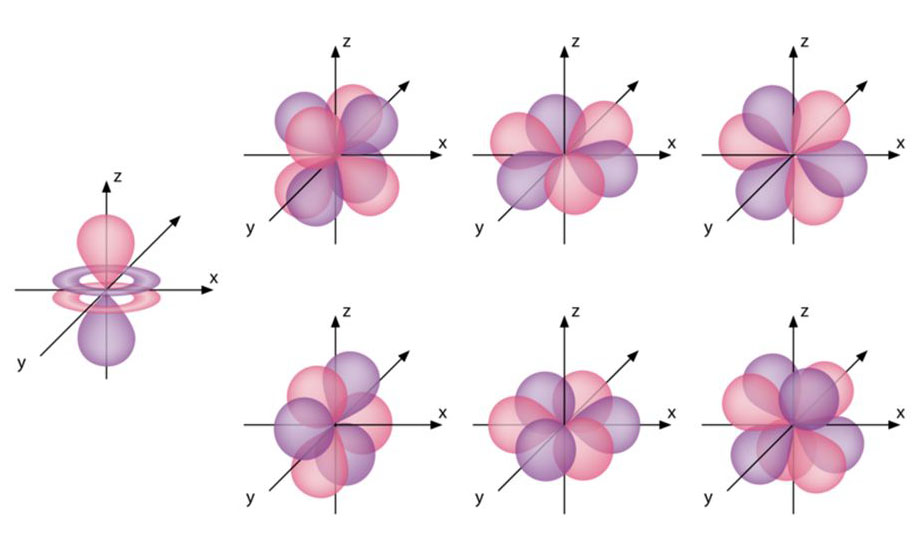
|
Decimocuarto ejercicio
Este ejercicio corresponde a la prueba de EBAU de Química de Andalucía del año 2016, convocatoria de junio.
a) Explica cuáles de los siguientes grupos de números cuánticos son imposibles para un electrón en un átomo: (4, 2, 0, +½) ; (3, 3, 2, -½) ; (2, 0, 1, +½) ; (4, 1, 1, -½).
b) Indica los orbitales donde se sitúan los electrones que corresponden con los grupos de números cuánticos anteriores que están permitidos.
c) Justifica cuál de dichos orbitales tiene mayor energía.
Relación entre números cuánticos y orbitales
Los valores de los números cuánticos n y l son los que usaremos para denotar los orbitales atómicos. Recuerda que esta notación se compone de un número, que coincide con el valor de n, y una letra, que está relacionada con el valor de l. En el siguiente cuadro puedes ver esta relación:
| Valor de número cuántico secundario (l) | Letra para denotar orbital |
| l = 0 | s |
| l = 1 | p |
| l = 2 | d |
| l = 3 | f |
A partir del valor l = 3, las letras que se asignarían para los orbitales seguirían el orden alfabético después de la "f". Aquí tienes varios ejemplos de cómo relacionar los números cuánticos para nombrar el orbital. Como puedes ver, cada tipo de orbital tendrá distintos valores de m, es decir, distintas orientaciones en el espacio.
|
n = 1 ; l = 0 n = 2 ; l = 0 n = 2 ; l = 1 n = 4 ; l = 2 n = 5 ; l = 3 |
1s 2s 2p 4d 5f |
m = 0 m = 0 m = -1, 0, 1 m = -2, -1, 0, 1, 2 m = -3, -2, -1, 0, 1, 2, 3 |
Decimoquinto ejercicio
Indica qué números cuánticos puedes asignar sin lugar a dudas a los siguientes orbitales: a) 3d ; b) 7f ; c) 4s ; d) 2p.
Obra publicada con Licencia Creative Commons Reconocimiento Compartir igual 4.0