-
Configuración electrónica y tipo de enlace 0001
Los elementos A, B, C y D pertenecen al mismo periodo y tienen 1, 3, 5 y 7 electrones de valencia, respectivamente. Indica, razonando la respuesta:
a) Qué elemento tiene la energía de ionización más alta y cuál la más baja.
b) Qué fórmulas tendrán los compuestos A-D y B-D.
c) Si el compuesto formado por B y D será iónico o covalente.
-
Estructura de Lewis e hibridación 0001
a) Escribe las estructuras de Lewis correspondientes a las moléculas etano (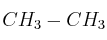 ) y eteno (
) y eteno (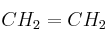 ).
).
b) Explica qué tipo de hibridación tiene el carbono en cada compuesto.
-
Ciclo de Born-Haber y energía reticular (1852)
a) Haz un esquema del ciclo de Born-Haber para el NaCl.
b) Calcula la energía reticular del NaCl(s), a partir de los siguientes datos:
– Entalpía de sublimación del sodio = 108 kJ/mol
– Entalpía de disociación del cloro = 243.2 kJ/mol
– Entalpía de ionización del sodio = 495.7 kJ/mol
– Afinidad electrónica del cloro = -348 kJ/mol
– Entalpía de formación del cloruro de sodio = -401.8 kJ/mol
-
Estructura de Lewis y polaridad 0001
a) Escribe la estructura de Lewis para las moléculas 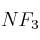 y
y 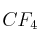 .
.
b) Dibuja la geometría de cada molécula según la Teoría de la Repulsión de los Pares de Electrones de la Capa de Valencia.
c) Considerando las geometrías moleculares, razona acerca de la polaridad de ambas moléculas.
-
Enlace químico y propiedades físicas (1797)
Dados los siguientes compuestos: 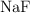 ,
, 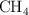 ,
, 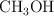 :
:
a) Indica el tipo de enlace.
b) Ordena de mayor a menor según su punto de ebullición. Razona tu respuesta.
c) Justifica la solubilidad o no en agua.