-
EBAU Madrid: química (junio 2022) pregunta B.1 (7643)
Dadas las siguientes especies: Fe, 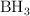 ,
, 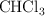 y
y 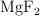 .
.
a) Justifica qué tipo de enlace presenta cada una de ellas.
b) Indica cuál/es conducirán la corriente en estado sólido y cuál/es lo harán en estado fundido.
c) Para las especies covalentes: indica y representa la geometría molecular, qué hibridación presenta el átomo central y justifica su polaridad.
-
EBAU Madrid: química (junio 2022) pregunta A.1 (7629)
Considera los elementos A (Z = 9 ) y B (Z = 13).
a) Escribe la configuración electrónica de cada uno.
b) Identifica el símbolo, nombre, grupo y periodo de cada elemento.
c) Justifica cuál es el elemento de menor energía de ionización.
d) Formula el compuesto binario formado por los elementos A y B, nómbralo e indica el tipo de enlace que presenta.
-
EBAU Andalucía: química (junio 2021) pregunta B.3 (7254)
Sean las moléculas: 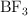 ,
, 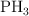 y
y 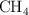 .
.
a) Razona en cuál de ellas el átomo central presenta algún par de electrones sin compartir.
b) Justifica la geometría que presentan las moléculas 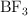 y
y 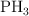 según la TRPECV.
según la TRPECV.
c) Indica la hibridación que presenta el átomo central en 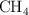 .
.
-
Cuestión sobre polaridad en enlace covalente y puentes de hidrógeno (5368)
Explica por qué:
a) Los enlaces con hidrógeno son más fuertes en el fluoruro de hidrógeno ( ) que en el agua (
) que en el agua (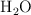 ).
).
b) Los puentes de hidrógeno son más importantes en el agua (temperatura de ebullición 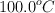 ) que en el fluoruro de hidrógeno (temperatura de ebullición
) que en el fluoruro de hidrógeno (temperatura de ebullición 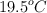 ).
).
-
Afinidad electrónica del cloro con ciclo de Born-Haber (4776)
Mediante el ciclo de Born-Haber calcula la afinidad electrónica del cloro conociendo los siguientes valores energéticos:
Energía de sublimación del sodio = 78 kJ/mol.
Energía de ionización del sodio = 402 kJ/mol.
Energía de disociación del cloro = 160 kJ/mol.
Energía reticular del NaCl = - 760 kJ/mol.
Entalpía de formación del NaCl(s) = - 552 kJ/mol.