Determina la tensión en la cuerda marcada, si p = 100 N.
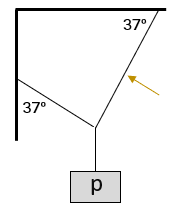
Determina la tensión en la cuerda marcada, si p = 100 N.

La unidad de presión en el Sistema Internacional (SI), el pascal (Pa), es una unidad muy pequeña. Para poder ilustrarlo, convierte un pascal en ![]() . Sabiendo que la presión atmosférica a nivel del mar es
. Sabiendo que la presión atmosférica a nivel del mar es ![]() , ¿a cuántos pascales equivale?
, ¿a cuántos pascales equivale?
La observación del movimiento de un sistema arroja unos datos que se representan según la gráfica adjunta.
a) ¿Qué tipo de movimiento sigue el sistema?
b) ¿Cuáles son las ecuaciones generales que describen su movimiento?
c) ¿Cuáles son las ecuaciones particulares para el sistema?
b) ¿A qué distancia del origen se encuentra el sistema al cabo de 7.2 s?
Un cuerpo se mueve hacia el origen con velocidad constante de ![]() . Si inicialmente se encuentra a una distancia de 100 m de este ¿cuánto tiempo tardará en pasar por él?
. Si inicialmente se encuentra a una distancia de 100 m de este ¿cuánto tiempo tardará en pasar por él?
Razona si son verdaderas o falsas las siguientes afirmaciones:
a) Dos masas iguales de los elementos A y B contienen el mismo número de átomos.
b) La masa atómica de un elemento es la masa, en gramos, de un átomo de dicho elemento.
c) El número de átomos que hay en 5 g de oxígeno atómico es igual al número de moléculas que hay en 10 g de oxígeno molecular.